
分析 (1)当雨水的pH<5.6时称为酸雨,根据物质的性质来书写方程式,一氧化氮和氧气反应生成二氧化氮,二氧化氮和二氧化硫反应生成三氧化硫和一氧化氮;催化剂在化学反应前后都存在,参与反应但反应前后质量和化学性质不变;
(2)根据信息可知:用CO还原SO2得到单质硫得方法来除去SO2,CO还原SO2得到单质硫和二氧化碳,据此书写反应的化学方程式;
(3)过量二氧化硫通入氨水中生成亚硫酸氢铵,+4价的硫被氧气氧化成+6价的硫,即再氧化成(NH4)2SO4;
(4)将NO、NO2完全转化为最高价含氧酸盐,NO、NO2最终转化为NaNO3,设出NO、NO2的物质的量,根据原子守恒、电子守恒列式计算各自的物质的量.
解答 解:(1)一氧化氮具有还原性,很容易被氧气氧化,反应的方程式为:2NO+O2=2NO2,二氧化氮能将二氧化硫氧化,反应的化学方程式为:NO2+SO2=SO3+NO,总反应为:2SO2+O2=2SO3,可见整个过程一氧化氮的质量没有变化,故NO在反应中作催化剂,
故答案为:2NO+O2=2NO2;NO2+SO2=SO3+NO;催化剂;
(2)CO还原SO2得到单质硫和二氧化碳,反应的化学方程式为:SO2+2CO$\frac{\underline{\;一定条件\;}}{\;}$S+2CO2,
故答案为:SO2+2CO$\frac{\underline{\;一定条件\;}}{\;}$S+2CO2;
(3)过量二氧化硫通入氨水中生成亚硫酸氢铵,化学方程式为:SO2+H2O+NH3=NH4HSO3,反应离子方程式为:NH3+SO2+H2O=NH4++HSO3-,+4价的硫被氧气氧化成+6价的硫,离子反应为:4NH3+2SO2+2H2O+O2=4NH4++2SO42-,
故答案为:4NH3+2SO2+2H2O+O2=4NH4++2SO42-;
(4)将NO、NO2完全转化为最高价含氧酸盐,NO、NO2最终转化为NaNO3,1mol氧气参与反应转移电子的物质的量为4mol,设出NO、NO2的物质的量分别为xmol、ymol,则:x+y=2.4(钠原子守恒),3x+y=4(电子守恒),解得:x=0.8,y=1.6,
故答案为:0.8 molNO;1.6 molNO2.
点评 本题考查了氮的氧化物的性质及其对环境的影响,氧化还原反应的有关计算等,注意生成氮的转化与转移电子的定量关系在(4)中的应用,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 4.28g | C. | 4.68g | D. | 5.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
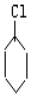 $→_{②}^{NaOH、乙醇}$
$→_{②}^{NaOH、乙醇}$ $→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$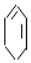

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH5中含有5NA个N-H键 | |
| B. | NH5中既含有共价键,又含有离子键,是离子化合物 | |
| C. | NH5的熔、沸点高于NH3 | |
| D. | NH5固体投入少量水中可产生两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤粉碎后燃烧 | B. | 通入大量的空气 | ||
| C. | 加入的煤越多越好 | D. | 将煤和空气在密闭的空间里燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 60gSiO2中含Si-O键的个数为2NA | |
| C. | 12 g石墨中含有C-C键的个数为1.5NA | |
| D. | 36 g戊烷中共价键的个数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{14}$ mol•L-1 | B. | $\frac{4}{5}$ mol•L-1 | C. | $\frac{1}{28}$ mol•L-1 | D. | $\frac{1}{42}$ mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com