

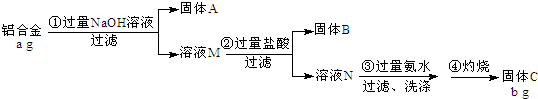
分析 石灰石煅烧得到CaO和CO2,向滤液2中加入足量石灰石煅烧产物之一,得到沉淀,加热沉淀得到氧化铝,则该沉淀为Al(OH)3,CO2通入偏铝酸盐溶液中得到Al(OH)3,所以原料B为强碱溶液,A为盐酸溶液,铝土矿中加入足量HCl,Al2O3、Fe2O3和稀盐酸反应生成AlCl3、FeCl3,SiO2不溶于稀盐酸,然后采用过滤方法得到残渣SiO2,滤液1中含有HCl、AlCl3、FeCl3,向滤液中加入足量NaOH溶液,AlCl3、FeCl3分别生成NaAlO2、Fe(OH)3,采用过滤方法得到沉淀Al(OH)3,滤液2中含有NaAlO2,向NaAlO2通入过量二氧化碳,生成Al(OH)3和NaHCO3,过滤得到的滤液3中溶质为NaHCO3,
(1)原料A的名称是稀盐酸,步骤①中氧化铝、氧化铁和稀盐酸反应生成盐和水;
(2)滤液1中要加入稍过量原料B,原料B的化学式是NaOH,酸和铁离子、铝离子和氢氧根离子反应;
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,二氧化硅和NaOH反应生成可溶性的硅酸钠,硅酸钠和二氧化碳反应生成沉淀硅酸,硅酸受热分解生成二氧化硅.
解答 解:石灰石煅烧得到CaO和CO2,向滤液2中加入足量石灰石煅烧产物之一,得到沉淀,加热沉淀得到氧化铝,则该沉淀为Al(OH)3,CO2通入偏铝酸盐溶液中得到Al(OH)3,所以原料B为强碱溶液,A为盐酸溶液,铝土矿中加入足量HCl,Al2O3、Fe2O3和稀盐酸反应生成AlCl3、FeCl3,SiO2不溶于稀盐酸,然后采用过滤方法得到残渣SiO2,滤液1中含有HCl、AlCl3、FeCl3,向滤液中加入足量NaOH溶液,AlCl3、FeCl3分别生成NaAlO2、Fe(OH)3,采用过滤方法得到沉淀Al(OH)3,滤液2中含有NaAlO2,向NaAlO2通入过量二氧化碳,生成Al(OH)3和NaHCO3,过滤得到的滤液3中溶质为NaHCO3,
(1)原料A的名称是稀盐酸,步骤①中氧化铝、氧化铁和稀盐酸反应生成盐和水,离子方程式分别为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,
故答案为:盐酸;Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O;
(2)滤液1含有HCl、AlCl3、FeCl3,要加入稍过量原料B,原料B的化学式是NaOH,酸和铁离子、铝离子和氢氧根离子反应,离子反应方程式为H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,
故答案为:NaOH;H++OH-=H2O;Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,二氧化硅和NaOH反应生成可溶性的硅酸钠,硅酸钠和二氧化碳反应生成沉淀硅酸,硅酸受热分解生成二氧化硅,所以得到的固体中还含有SiO2,故答案为:SiO2.
点评 本题考查物质分离和提纯,为高频考点,明确物质的性质是解本题关键,知道流程图中发生的反应、操作方法及溶液中的溶质,注意氧化铝的两性,注意滤液1中还含有HCl、滤液2中还含有NaOH.


科目:高中化学 来源: 题型:选择题
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) | (11) | (12) |
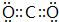
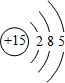 .
.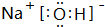 含有化学键为离子键、共价键
含有化学键为离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 酸性强弱:H2CO3<H2SiO3<HNO3 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 非金属性强弱:P>S>Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com