
| A. | CH4 | B. | NH3 | C. | H2O | D. | HF |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:l | C. | 1:2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的离子方程式为CO32-+2H+═CO2↑+H2O | |
| B. | 与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大 | |
| C. | CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使其ksp增大 | |
| D. | CaCO3与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液加入等质量的锌粉,产生氢气的速率相同 | |
| B. | 两溶液中氢氧根离子浓度均为10-13 mol/L | |
| C. | 加入醋酸钠固体,二者的pH均增大 | |
| D. | 恰好完全反应时,二者消耗氢氧化钠的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>B>C>A | |
| B. | 金属性:B>C | |
| C. | A、D最高化合价与最低化合价的代数和分别为0和6 | |
| D. | B和A、C形成的氧化物均不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.
氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷的沸点低于甲烷,密度大于甲烷 | |
| B. | 相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃 | |
| C. | 苯酚在任何温度下,均微溶于水 | |
| D. | 酯在碱性条件下的水解反应均为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗1molH2,同时生成2molHI | |
| B. | 每断裂AmolH-I,同时有$\frac{A}{2}$molH-H断裂 | |
| C. | 容器中压强不再变化 | |
| D. | 容器中混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
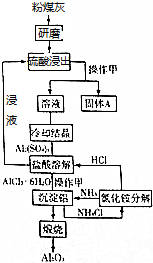 我国煤炭丰富、电离偏紧的资源特征决定了在今后相当长一段时间内,火力发电仍将在电力工业中占据重要地位.粉煤灰是火电厂排出的主要固体废物.其中粉煤灰中主要含有SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如图所示:
我国煤炭丰富、电离偏紧的资源特征决定了在今后相当长一段时间内,火力发电仍将在电力工业中占据重要地位.粉煤灰是火电厂排出的主要固体废物.其中粉煤灰中主要含有SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如图所示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com