
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 分子式为C5H12O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为戊醇,可以看作羟基取代戊烷形成的醇,戊烷有正戊烷、异戊烷、新戊烷,结合等效氢判断可能存在的醇;再根据“它是烯烃在一定条件下与水发生加成反应的产物”进行分析M的可能结构.
解答 解:分子式为C5H12O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,且M是烯烃在一定条件下与水发生加成反应的产物,则M能够发生消去反应,
该物质为戊醇,可以看作羟基取代戊烷形成的醇,戊烷有正戊烷、异戊烷、新戊烷,
CH3CH2CH2CH2CH3分子中有3种H原子,被-OH取代得到3种醇,且得到的3种醇都能够发生消去反应;
CH3CH2CH(CH3)2分子中有4种H原子,被-OH取代得到4种醇,且4种醇都能够发生消去反应;
C(CH3)4分子中有1种H原子,被-OH取代得到1种醇,该醇不能发生消去反应;
所以满足条件的有机物有7种,
故选C.
点评 本题考查有机物的推断、同分异构体的书写等知识,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握同分异构体的概念及书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体中 | 固体变白 | 浓硫酸有脱水性 |
| B | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
| C | 向某溶液中加入BaCl2溶液,再向溶液中加入盐酸 | 产生白色沉淀 | 该溶液中含有SO42- |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | |
| B. | 原子半径:X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 最简单气态氢化物的稳定性:X>W>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个反应能否自发进行,由焓变、熵变、反应温度共同决定 | |
| B. | 在同一条件下,不同物质有不同的熵变,其体系混乱度越大,熵值越小 | |
| C. | 自发进行的反应一定能迅速发生 | |
| D. | 低温时,吸热且熵减的反应可能会自发发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| B. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 碳酸氢钠溶液与盐酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.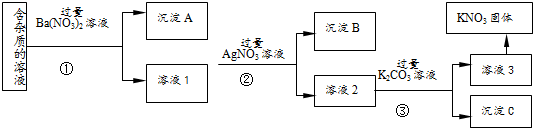
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com