
【题目】铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料。合成铃兰醛的路线如图所示(部分试剂和条件未注明):



请回答下列问题:
(1)A的系统命名为:__________________;B→D的反应类型:_______________
(2)A→B的化学方程式是___________________________________________;
(3)H→铃兰醛的化学方程式是___________________________________________;
(4)下列有关G的叙述中,不正确的是______(填序号)。
A.G分子中有6种不同化学环境的氢原子
B.G能发生消去反应、氧化反应和还原反应
C.1molG最多能与5molH2发生加成反应
D.G能使溴水褪色
(5)H的同分异构体有多种,试写出满足以下条件的一种结构简式:__________。
①遇FeCl3溶液呈紫色,②核磁共振氢谱中有四种类型氢原子的吸收峰。
【答案】 2-甲基-1-丙烯 或 2-甲基丙烯 取代反应 CH2=C(CH3)2+HCl→(CH3)3CCl 2 +O2→ 2
+O2→ 2 + 2H2O B
+ 2H2O B  或
或  或
或 或
或 
【解析】试题分析:(1)由B到D的反应类似已知ii的反应,D被酸性高锰酸钾溶液氧化的产物的结构简式题目已给出,所以D的结构简式为 ,B是由(CH3)3CCl;逆推A是CH2=C(CH3)2;
,B是由(CH3)3CCl;逆推A是CH2=C(CH3)2;
(2)有铃兰醛的结构简式可逆推H是 ,G是
,G是 ;由G逆推F是
;由G逆推F是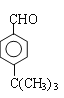 。
。
解析:根据以上分析,(1) A是CH2=C(CH3)2,系统命名为:2-甲基丙烯;(CH3)3CCl与甲苯生成 和氯化氢,反应类型为取代反应;
和氯化氢,反应类型为取代反应;
(2)CH2=C(CH3)2与氯化氢发生加成反应生成(CH3)3CCl的化学方程式是
CH2=C(CH3)2+HCl→(CH3)3CCl ;
(3) 氧化为铃兰醛的化学方程式是
氧化为铃兰醛的化学方程式是
2 +O2
+O2 ![]() → 2
→ 2 + 2H2O;
+ 2H2O;
(4) 分子中有6种不同化学环境的氢原子,故A正确;
分子中有6种不同化学环境的氢原子,故A正确;
 不能发生消去反应,故B错误;
不能发生消去反应,故B错误;
C.苯环、碳碳双键、醛基都能与氢气加成,1mol 最多能与5molH2发生加成反应,故C正确;
最多能与5molH2发生加成反应,故C正确;
 含有醛基、碳碳双键,所以能使溴水褪色,故D正确。
含有醛基、碳碳双键,所以能使溴水褪色,故D正确。
(5)符合①遇FeCl3溶液呈紫色说明含有酚羟基;②核磁共振氢谱中有四种类型氢原子的吸收峰的H的同分异构体有 或
或  或
或 或
或  。
。


科目:高中化学 来源: 题型:
【题目】如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )

①2∶7 ②5∶4 ③4∶5 ④7∶2
A.①② B.③④ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于的说法正确的是
![]()
A. 所有碳原子有可能都在同一平面上
B. 最多可能有9个碳原子在同一平面上
C. 只可能有3个碳原子在同一直线上
D. 有7个碳原子可能在同一条直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g),阻碍循环反应的进行。
3Fe(s)+4 CO2(g),阻碍循环反应的进行。

① 已知:Fe3O4(s) + CO(g) ![]() 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g)![]() Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2![]() 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________。
② 下图表示其他条件一定时, Fe3O4(s)和 CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。

i. 当温度低于570℃时,温度降低CO的转化率____(填“增大”、“减小”或“不变”),理由是______。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) ![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
(3)① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________。
② 如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________。
(4)已知25℃时,Kap[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________mL(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | 升华 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Cu | CuO | 稀硫酸,过滤 |
D | CaCO3 | CaO | 盐酸,过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:

(1)周期表中第三周期第IIA族的元素是__________;
(2)P、S、Cl三种元素中,非金属性最强的是________(填元素符号);
(3)钠元素最高价氧化物对应的水化物化学式是________,常温下该水化物溶液的pH____7(填“>”或“<”或“=”);
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____反应(填“放热”或“吸热”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室下列物质的保存方法中,不正确的是
A. 铝片可以保存在不密封容器中
B. 氢氧化钠溶液盛装在带玻璃塞的试剂瓶中
C. 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D. 新制的氯水应避光保存,放在冷暗处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)GaAs是新型半导体材料,第一电离能As__________Ga(填“>”或“<”),GaCl3与AsCl3的中心原子的杂化方式分别为______、______,分别写出一个与它们互为等电子体的分子______、________。
(2)TiO2离子晶体的其中一种晶胞如图1所示,则Ti、O配位数之比为_________;影响离子晶体结构类型的因素有______、______ 、键性因素。

(3)基态铜原子的电子排布式是______。基态铜原子价电子层排布依据的原理,可用于解释下列事实的是_____(填标号)。
A.Fe2+易被氧化为Fe3+ B.铜丝灼烧时焰色呈绿色
C.N的第一电离能大于O的第一电离能 D.NaCl的熔点比KCl的高
(4)铜的堆积方式(如图2)和晶胞结构(如图3)所示。若晶胞顶点A与堆积方式中的A球相对应,则晶胞中x、y、z三点与堆积方式中C球相对应的点是______。

已知铜原子的半径为r cm、摩尔质量为Mg/mol、晶体的密度为_________g/cm3(阿伏加德罗常数取NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com