
| A. | X、Y元素能与氢形成分子式为H2XY2、H4X2Y2等弱酸 | |
| B. | 化合物ZY2中只含有离子键 | |
| C. | 工业上可用X单质置换ZY得到Z单质 | |
| D. | Y的氢化物的沸点比其下一周期的同族元素的氢化物的沸点低 |
分析 短周期元素X、Y、Z的原子序数依次递增,Y原子最外层电子数是X原子内层电子数的3倍或者Z原子最外层电子数的3倍,则X的内层电子数为2,Y的最外层电子数为6,Z的最外层电子数为2,Z的原子序数大于Y,则Y为O元素,Z为Mg元素;三种元素的最外层电子数之和等于Z的原子序数,则X的最外层电子数为12-6-2=4,而且X的原子序数比O元素小,则X为C元素,结合元素及其化合物来解答.
解答 解:短周期元素X、Y、Z的原子序数依次递增,Y原子最外层电子数是X原子内层电子数的3倍或者Z原子最外层电子数的3倍,则X的内层电子数为2,Y的最外层电子数为6,Z的最外层电子数为2,Z的原子序数大于Y,则Y为O元素,Z为Mg元素;三种元素的最外层电子数之和等于Z的原子序数,则X的最外层电子数为12-6-2=4,而且X的原子序数比O元素小,则X为C元素,
A.X为C元素,Y为O元素,X、Y元素能与氢形成分子式为H2CO2、H4C2O2,即HCOOH、CH3COOH等弱酸,故A正确;
B.化合物ZY2为MgO2,含有离子键和共价键,故B错误;
C.在高温条件下C与MgO反应生成Mg和CO,工业上可用C单质置换MgO得到Mg单质,故C正确;
D.Y的氢化物为H2O,其分子间存在氢键沸点比下一周期的同族元素的氢化物的沸点高,故D错误;
故选AC.
点评 本题考查原子结构、元素周期律,利用原子结构来推断元素是解答本题的关键,注意短周期元素的内层电子只能为2或8,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:实验题
某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
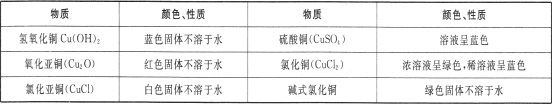
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为。
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗 涤、干燥,连接下列装置进行实验,验证阴极产物,
涤、干燥,连接下列装置进行实验,验证阴极产物,
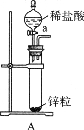
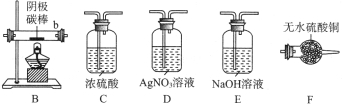
①实验前,检查装置A气密性的方法是。
②实验 时,各装置从左至右的连接顺序为A→→→B→→。
时,各装置从左至右的连接顺序为A→→→B→→。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O(填“是”或“否”),理由是;②装置(填上图中装置编号)中的现象说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成→消去→取代 | B. | 消去→加成→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
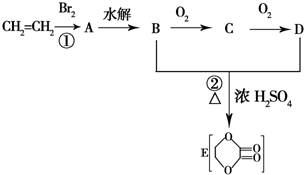 由乙烯和其他无机原料合成环状 化合物其合成过程如图(水及其他无机产物均已省略):
由乙烯和其他无机原料合成环状 化合物其合成过程如图(水及其他无机产物均已省略):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
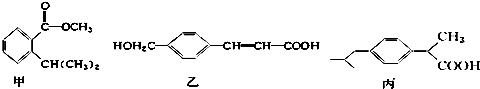
| A. | 甲、乙、丙都是芳香族化合物,只有两种能与碳酸氢钠溶液反应 | |
| B. | 只用碳酸氢钠溶液和银氨溶液能检验甲、乙、丙 | |
| C. | 与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3:4:3 | |
| D. | 甲的化学式为C11H14O2,乙含有两种含氧官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 8.4g | C. | 16.8g | D. | 22.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应:2N02 (红棕色)?N204 (无色)△H<0.将一定量的N02充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2N02 (红棕色)?N204 (无色)△H<0.将一定量的N02充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若不忽略体系温度变化,且没有能量损失,则 r(b)>r(c) | |
| D. | d 点:v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com