
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用所作的判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C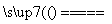 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2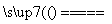 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C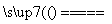 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的主要成分被消耗,用于雕刻玻璃
b.反应②中SiO2表现为氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④中SiO2将挥发性的酸酐从其盐中置换出来
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde
C.cde D.dab
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
下列有关硅及其化合物的说法正确的是( )。
A.单质硅常用作半导体和光导纤维材料
B.硅在自然界中只以化合态的形式存在
C.SiO2与纯碱高温生成CO2,说明硅酸的酸性比碳酸强
D.SiO2是非金属氧化物,它不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)
 2C(g)+2D(g),2 min 后反应达到平衡状态,生成了0.8 mol D。则用B表示的平均反应速率为_______________________________________________________;
2C(g)+2D(g),2 min 后反应达到平衡状态,生成了0.8 mol D。则用B表示的平均反应速率为_______________________________________________________;
A的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图a、b、c、d均为石墨电极,通电进行电解,b极有64 g Cu析出。
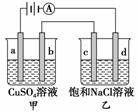
下列说法不正确的是( )
A.甲中a电极反应式为4OH--4e-===O2↑+2H2O
B.电解时向乙中滴入酚酞溶液,d电极附近变红
C.向乙中通入2 mol HCl气体,溶液组成可以恢复
D.c电极产生2 g气体
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是( )
A.液氨作为清洁能源的反应原理是4NH3+5O2 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气密度小,标准状况下密度约为0.76 g·L-1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中,Br2与Na2SO3反应的离子方程式:__________________________________________________________。
(2)反应后,溶液含有SO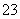 、SO
、SO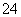 、Br-、OH-等阴离子,下表是某同学鉴定其中SO
、Br-、OH-等阴离子,下表是某同学鉴定其中SO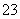 、SO
、SO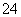 和Br-的实验报告,请完成未填完的部分。
和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1盐酸;1 mol·L-1H2SO4溶液;1 mol·L-1BaCl2溶液;1 mol·L-1Ba(NO3)2溶液;CCl4、新制饱和氯水、品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管中,加入过量的2 mol·L-1盐酸,再滴加适量1 mol·L-1BaCl2溶液 | 有白色沉淀生成,证明待测液中含SO |
| 步骤② | ||
| 步骤③ |
(3)为测定上述样品的纯度,该同学取10.0 g试样,配成250 mL溶液,取25.00 mL所配溶液,用0.10 mol·L-1的酸性KMnO4溶液滴定至终点。离子反应为2MnO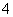 +5SO
+5SO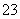 +6H+===2Mn2++5SO
+6H+===2Mn2++5SO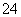 +3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
+3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
①该试样中Na2SO3的质量分数为________(结果保留3位有效数字);
②操作时,若未用0.10 mol·L-1的酸性KMnO4溶液润洗滴定管,会导致测定结果________(填“偏高”、“偏低”或“没有影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3·H2O在水溶液中的电离方程式为_____________________________________________,
其电离常数表达式为_____________________________________________________________。
只改变下列一种条件:
①升高温度 ②加水稀释 ③加少量NaOH(s) ④通少量HCl(g) ⑤加入NH4Cl(s) ⑥加入Na2CO3(s)
其中能实现下列要求的是:
(1)使电离平衡正向移动的有________。
(2)使c(NH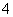 )减小的有________。
)减小的有________。
(3)使c(H+)增大的有________。
(4)使平衡常数Kb增大的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
简要回答下列问题
(1)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO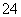 等杂质。某次除杂操作时,往粗盐水中先加入过量的________________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。某次除杂操作时,往粗盐水中先加入过量的________________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO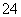 ,其原因是________________________________________________________________________
,其原因是________________________________________________________________________
[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9]。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与资源、环境、生活关系密切,下列说法正确的是( )
A.空气中PM2.5(2.5微米以下的颗粒物)的存在能够形成丁达尔效应
B.煤燃烧时加入少量的生石灰可以减少废气中的二氧化硫排放
C.将造纸废水通过高压水井压到地下,节约生产成本
D.绿色化学的核心是应用化学原理对环境污染进行治理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com