
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH,则丁可能是CO2
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液区别的一种试剂是( )
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.NaOH
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:简答题
5.8g有机物完全燃烧,只生成CO2和H2O气其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增加18.6g,同量的有机物与0.1 mol乙酸完全发生酯化反应。又知该有机物对空气的相对密度为2。
求:(1)有机物的相对分子质量;
(2)有机物的分子式;
(3)此有机物的名称。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列溶液中:①石灰水 ②Na2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液
⑥品红溶液,不能区别SO2和CO2气体的是( )
A.只有① B.①② C.①②⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高一上学期期末考试化学(理)试卷(解析版) 题型:填空题
)俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯。回答下列问题:
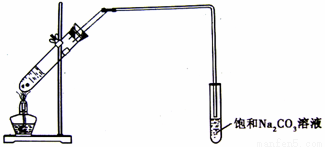
(1)写出制取乙酸乙酯的化学方程式 (3分)。
(2)浓硫酸的作用是 、 。
(3)饱和Na2CO3溶液的主要作用之一是能除去乙酸乙酯中的某种杂质,该反应的离子方程式为 。
(4)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是为了防止 。
(5)若要把制得的乙酸乙酯分离出来,应采取的实验操作是 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化成生成物,反应一段时间后,就达到了该反应限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高一上学期期末考试化学(理)试卷(解析版) 题型:选择题
下列变化中,不属于化学变化的是
A.SO2使品红褪色 B.氯水使有色布条褪色
C.活性炭使红墨水褪色 D.漂白粉使某染料褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)【化学—选修3:物质结构与性质】
a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态; d为周期表前四周期中电负性最小的元素;f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出ac2的电子式__________;基态f原子的外围电子排布式为 。
(2)写出一种与ac2互为等电子体的物质的化学式 。
(3)b的简单氢化物的沸点比同族元素氢化物的沸点 。(填“高”或“低”)

(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 。
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石。试回答:①N的晶体类型为________________________,其硬度超过金刚石的原因是___________________。
②N晶体中a、b两元素原子的杂化方式均为___________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
(15分)某校一研究性学习小组对胆矾晶体受热分解进行讨论。
Ⅰ.他们查阅资料得知:将胆矾晶体置于烘箱中加热时,在79~134℃,晶体失重14.4%;134~250℃,又失重14.4%;250~300℃,再失重7.2%。之后加热至620℃,质量维持不变。小组经过计算得出,胆矾在300~620℃的固体残留物为无水硫酸铜,134℃时的固体残留物的化学式为 。
Ⅱ.小组对无水硫酸铜继续升温加热的可能变化进行猜想。他们提出了产物的以下几种猜想:
①.CuO、SO3 ;。
②.CuO、SO2和O2;
③.CuO、SO3和SO2;
④.CuO、SO3、SO2和O2
小组经过激烈讨论,认为猜想③不用实验就可排除,他们的理由是
查阅资料:①SO3为无色晶体,熔点16.6℃,沸点44.8℃。
②SO2,熔点:-72.4℃,沸点:-10℃;SO2通入BaCl2溶液中,无明显现象。
Ⅲ.实验探究:
小组按下图所示安装好实验装置。

(1)安装好装置后,未装药品前必须进行的操作是 。
D装置的作用是 。
(2)按图示装好药品后,用酒精喷灯对着硬质试管加热。一会儿后,B中溶液产生白色浑浊,C中溶液逐渐褪色。
Ⅳ.实验结果分析:
(1)小组同学大多认为无水硫酸铜热分解产物应该为猜想④。但有一个同学提出质疑,他认为B中溶液产生白色浑浊并不一定能确定产物中含有SO3。他的依据涉及的化学方程式是 。于是,小组同学经讨论决定,再增加一个装置E,你认为该装置应加在 (填装置字母)之间。增加装置后,小组重新实验,证明了产物中确实存在SO3。你认为他们根据什么现象得到这一结论? 。
(2)小组在完成无水硫酸铜热分解的化学方程式时遇到了困难。他们发现该化学方程式为不定方程式,存在无数种配平情况,经过慎密地分析,他们认为只要能确定某些物质的计量数之比,即可确定该化学方程式。如已知SO2与SO3的计量数之比,就能确定该化学方程式。若设SO2与SO3的计量数之比为x,请写出配平后的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公 众关注的焦点。铊的相关信息如下图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子。下列有关卡片信息解读不正确的是
众关注的焦点。铊的相关信息如下图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子。下列有关卡片信息解读不正确的是
A.铊的元素符号为Tl B.铊原子的中子数为204
C.铊位于第六周期ⅢA族 D.铊的金属性比铝的金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com