
向盛有400 mL某浓度稀HNO3的大烧杯中加入W g铁粉(还原产物以NO计),充分反应后,铁粉质量减少16.8 g,再往烧杯中加入V mL 4.0 mol·L-1的稀H2SO4,充分反应后,铁粉质量又减少8.4 g,此时铁粉仍有剩余。求:
(1)稀HNO3的物质的量浓度。
(2)V的值。
(3)要使反应中有H2生成,W的取值范围__________。
(1)2.0 mol-1·L-1(2)50 mL
(3)W>67.2 g
(1)
3Fe + 8HNO3====3Fe(NO3)2+2NO↑+4H2O
3 8
![]() n1
n1
n1(HNO3)=0.8 mol
c(HNO3)=![]() 2. 0 mol·L-1
2. 0 mol·L-1
(2)3Fe + 8H++2![]() ==== 3Fe2++2NO↑+4H2O
==== 3Fe2++2NO↑+4H2O
3 8
![]() n2
n2
n2(H+)=0.4 mol
需V(H2SO4)=![]() 0.05 L,即50 mL。
0.05 L,即50 mL。
(3)由于加入HNO3 0.8 mol,则若要放出H2时需将所有的HNO3消耗完。
3Fe+8H++2![]() ====3Fe2++2NO↑+4H2O
====3Fe2++2NO↑+4H2O
3 2
n3 0.8 mol
n3(Fe)=![]() mol
mol
m(Fe)=1.2 mol×56 g·mol-1=67.2 g W>67.2 g


科目:高中化学 来源:2013-2014学年陕西省西安市高三上学期期中考试化学试卷(解析版) 题型:选择题
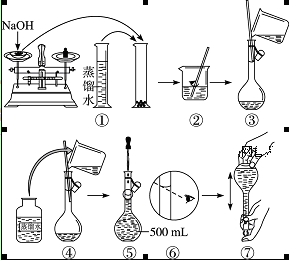
配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解NaOH的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
(5)在下列配制0.5 mol·L-1 NaOH溶液过程示意图中有错误的是(填序号)______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com