
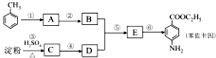
 甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
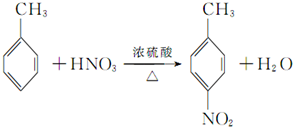 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.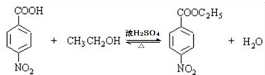 .
.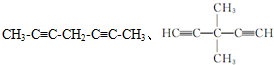 .
.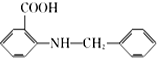 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图: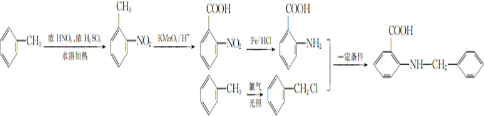 .
.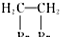
分析 B与D反应生成E,E再转化得到苯佐卡因,结合转化关系可知,C为葡萄糖,D为乙醇,反应①是甲苯发生硝化反应生成A为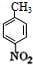 ,再用酸性高锰酸钾溶液氧化生成B为
,再用酸性高锰酸钾溶液氧化生成B为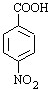 ,D与E发生酯化反应生成E为
,D与E发生酯化反应生成E为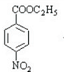 ,最后用Fe/HCl还原得到苯佐卡因.
,最后用Fe/HCl还原得到苯佐卡因.
(6)要合成 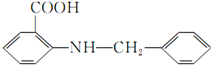 ,先制备
,先制备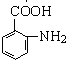 、
、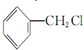 ,甲苯先发生邻位位置的硝化反应,然后用酸性高锰酸钾溶液将甲基氧化为羧基,再用Fe/HCl将硝基还原为氨基,制备
,甲苯先发生邻位位置的硝化反应,然后用酸性高锰酸钾溶液将甲基氧化为羧基,再用Fe/HCl将硝基还原为氨基,制备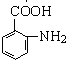 ,甲苯与氯气在光照条件下得到
,甲苯与氯气在光照条件下得到 .
.
解答 解:B与D反应生成E,E再转化得到苯佐卡因,结合转化关系可知,C为葡萄糖,D为乙醇,反应①是甲苯发生硝化反应生成A为 ,再用酸性高锰酸钾溶液氧化生成B为
,再用酸性高锰酸钾溶液氧化生成B为 ,D与E发生酯化反应生成E为
,D与E发生酯化反应生成E为 ,最后用Fe/HCl还原得到苯佐卡因.
,最后用Fe/HCl还原得到苯佐卡因.
(1)C为葡萄糖,化合物C中官能团的结构简式为-OH、-CHO,淀粉与碘变蓝色,用碘判断淀粉是否完全水解,在碱性条件下用银氨溶液或新制氢氧化铜检验淀粉是否水解,
故答案为:-OH、-CHO;碘水、NaOH溶液、银氨溶液(或新制氢氧化铜);
(2)合成路线中反应①属于取代反应,反应②属于氧化反应,反应③属于水解反应,反应⑤属于酯化反应,反应⑥属于还原反应,属于取代反应的有①③⑤,
故答案为:3;
(3)反应①的化学方程式为: ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯,
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯,
故答案为: ;2,4,6-三硝基甲苯;
;2,4,6-三硝基甲苯;
(4)反应⑤的化学方程式为  ,
,
故答案为: ;
;
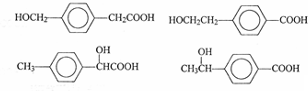
(5)甲苯的链状且仅含碳碳三键的同分异构体有2个碳碳三键,碳链为7个碳原子时,碳链为C≡C-C≡C-C-C-C,C≡C-C-C≡C-C-C,C≡C-C-C-C≡C-C,C≡C-C-C-C-C≡C,C-C≡C-C≡C-C-C,C-C≡C-C-C≡C-C.碳链有6个碳原子,碳链为C≡C-C≡C-C-C,C≡C-C-C≡C-C,C≡C-C-C-C≡C,甲基分别有1种位置,碳链含有5个碳原子为C≡C-C≡C-C,C≡C-C-C≡C,前者不是最长的碳链,后者之间碳原子可以连接乙基或2个甲基,故符合条件的同分异构体共有11种,其中满足下列条件的同分异构体:①核磁共振氢谱只有两个吸收峰,②峰面积之比为1:3,符合条件同分异构体为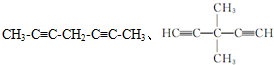 ,
,
故答案为:11;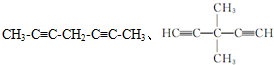 ;
;
(6)要合成 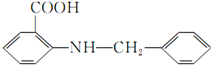 ,先制备
,先制备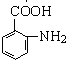 、
、 ,甲苯先发生邻位位置的硝化反应,然后用酸性高锰酸钾溶液将甲基氧化为羧基,再用Fe/HCl将硝基还原为氨基,制备
,甲苯先发生邻位位置的硝化反应,然后用酸性高锰酸钾溶液将甲基氧化为羧基,再用Fe/HCl将硝基还原为氨基,制备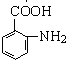 ,甲苯与氯气在光照条件下得到
,甲苯与氯气在光照条件下得到 ,合成路线流程图为:
,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的合成及推断、有机反应类型、有机物的检验、限制条件同分异构体书写等,(5)之间同分异构体的书写为易错点,注意在有机合成中羧基、氨基引入的先后书写.


科目:高中化学 来源: 题型:选择题
| A. | 酒精的实验式为:C2H6O | B. | 原子核中有7个中子的碳原子:136C | ||
| C. | 铝离子的电子式:Al3+ | D. | 二氧化硅的结构式O═Si═O |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO2-4,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: 。
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: 。
(3)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式: 。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: 。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
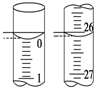 环境监测测定水中溶解氧的方法是:
环境监测测定水中溶解氧的方法是:| 滴定次数 | 待测液的体积/mL | 0.1000mol•L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
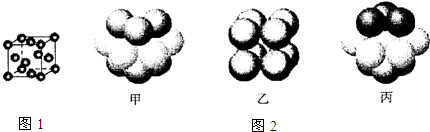
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Fe3+Br2 | Cl- | |
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组的反应可能有一种或两种元素被氧化 | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
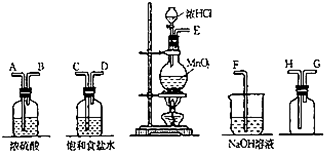 实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
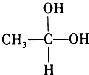 →CH3-CHO+H2O
→CH3-CHO+H2O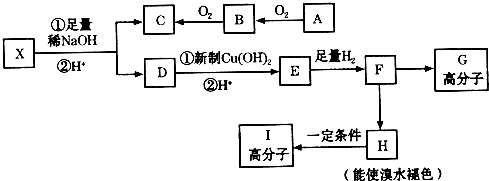
 .
. .
. .
. 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com