
【题目】阿伏加德罗常数用![]() 表示,下列叙述正确的是
表示,下列叙述正确的是![]()
①![]() 含有电子数为
含有电子数为![]()
②![]() 中含有的
中含有的![]() 键总数目为
键总数目为![]()
③![]()
![]() 与
与![]() 完全反应时转移电子数为
完全反应时转移电子数为![]()
④![]() 硅晶体中含有
硅晶体中含有![]() 个
个![]() 键
键
⑤![]() 通入足量氢氧化钠溶液中充分反应,转移的电子数等于
通入足量氢氧化钠溶液中充分反应,转移的电子数等于![]()
⑥![]() ,
,![]()
![]() 溶液中,
溶液中,![]() 和
和![]() 离子数的总和是
离子数的总和是![]()
⑦在常温常压下,![]() 铁与
铁与![]()
![]() 充分反应,转移的电子数为
充分反应,转移的电子数为![]()
⑧![]() 和
和![]() 的混合物共
的混合物共![]() ,其中所含原子数一定为
,其中所含原子数一定为![]() .
.
A.①②③⑤⑧B.②④⑥⑦⑧C.①③⑤⑥⑦D.①②④⑧
【答案】D
【解析】
①T2O的摩尔质量为22g/mol,故22gT2O的物质的量为1mol,而1molT2O含有10mol电子,即10NA个,故①正确;
②0.44gC3H8的物质的量n=0.44g÷44g/mol=0.01mol,而1mol丙烷中含10molσ键,故0.01mol丙烷中含0.1molσ键,即0.1NA个,故②正确;
③![]() 与
与![]() 的反应为歧化反应,1mol过氧化钠转移1mol电子,即NA个,故③错误;
的反应为歧化反应,1mol过氧化钠转移1mol电子,即NA个,故③错误;
④28g硅晶体中含有1molSi原子,晶体硅中,每个硅原子与其它4个Si形成4个SiSi键,则每个硅原子形成的共价键为:12×4=2,则1mol单质硅含有2molSiSi键,含有2NA个SiSi键,故④正确;
⑤11.2LCl2所处的状态不明确,不一定是标况下,其物质的量不一定是0.5mol,故⑤错误;
⑥Al3+是弱碱阳离子,在溶液中会水解导致其个数减少,故溶液中的Al3+和![]() 离子数的总和小于NA,故⑥错误;
离子数的总和小于NA,故⑥错误;
⑦0.1mol铁与0.1molCl2反应时,铁过量,应根据氯气的量来计算转移的电子的数目,由于反应后氯元素变为1价,,故0.1mol氯气转移0.2mol电子即0.2NA个,故⑦错误;
⑧O2和O3的均由氧原子构成,故只要O2和O3的混合物共6.4g,无论两者的比例如何,其含有的氧原子的物质的量n=6.4g÷16g/mol=0.4mol,即为0.4NA个,故⑧正确。
故选:D。


科目:高中化学 来源: 题型:
【题目】利用反应CCl4 +4Na![]() C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
C(金刚石)+4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是( )
A.C(金刚石)属于原子晶体
B.该反应利用了Na的强还原性
C.CCl4和C(金刚石)中的C的杂化方式相同
D.NaCl晶体中每个Cl-周围有8个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某兴奋剂的结构简式如下图所示。下列有关说法正确的是 ( )
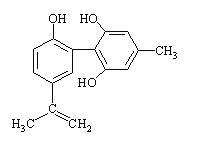
A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 滴入酸性KMnO4溶液,紫色褪去,即证明其结构中肯定存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为2 mol和7 mol
D. 该分子中的所有碳原子可以共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.5 mol/L的盐酸与50 mL 0.5 mol/L的NaOH 溶液在下图所示的装置中进行中和热测定实验,下列说法不正确的是
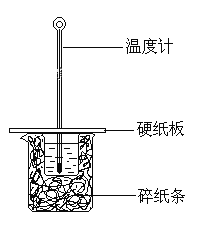
A.图中实验装置缺少环形玻璃搅拌棒,烧杯间填满碎纸条的主要作用是固定小烧杯
B.稀溶液中:H+ (aq) + OH— (aq) = H2O (l) ΔH=-57.3kJ·mol-1 ,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3kJ
C.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
D.若改用55 mL 0.50 mol/L的盐酸跟50 mL0.5 mol/L的NaOH溶液进行实验,从理论上说所求中和热相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个实验装置是实现化学能和电能相互转化的装置。
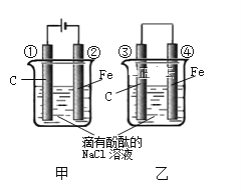
(1)把电能转化为化学能的装置是________(填“甲”或“乙”)
(2)铁电极腐蚀更严重的装置是_______(填“甲”或“乙”)
(3)②电极上的电极反应式为______________ ③电极上的电极反应式为________
(4)甲、乙两装置电极附近的溶液首先变红的电极是 ______
a.①② b②③ c③④ d①④
(5)写出装置甲反应的离子方程式 ________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物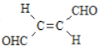 ,下列叙述正确的有( )
,下列叙述正确的有( )
A.分子间可形成氢键B.分子中既有极性键又有非极性键
C.分子中有7个![]() 键和1个
键和1个![]() 键D.C原子的杂化方式是sp2和sp3
键D.C原子的杂化方式是sp2和sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭的容器中加入N2(g)和H2(g),发生反应N2(g)+3H2(g)2NH3(g) △H<0在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( )

A.t0-t1B.t2-t3
C.t3-t4D.t5-t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的分子式为![]() ,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为
,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为![]() 和
和![]() ,已知
,已知![]() 分子的键角为
分子的键角为![]() 。下列推断不正确的是
。下列推断不正确的是 ![]()
![]()
A.![]() 分子的空间构型为V形
分子的空间构型为V形
B.![]() 键为极性共价键,
键为极性共价键,![]() 分子为非极性分子
分子为非极性分子
C.![]() 分子中A原子采取
分子中A原子采取![]() 杂化
杂化
D.![]() 分子中无H原子,分子间不能形成氢键
分子中无H原子,分子间不能形成氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com