
| A. | ①② | B. | ②③④ | C. | ②④⑤ | D. | ①②③④⑤ |
分析 ①相邻原子间的强烈的相互作用叫化学键;
②两个非金属原子间只能以共用电子对结合;
③非金属原子间可形成离子键;
④共价键可存在于单质、离子化合物、共价化合物中;
⑤部分共价化合物在水中能电离,其水溶液能导电.
解答 解:①相邻原子之间的强烈的相互作用是化学键,原子可以是带电荷的原子即离子,可以是不带电荷的原子,故正确;
②两个非金属元素原子间只能形成共价键,不可能形成离子键,故正确;
③非金属原子间可形成离子键,如铵盐为离子化合物,故错误;
④共价键可存在于单质、离子化合物、共价化合物中,如离子化合物NaOH中含O-H共价键,故错误;
⑤部分共价化合物在水中能电离,其水溶液能导电,如HCl在溶液中完全电离出氯离子和氢离子,HCl的溶液能导电,HCl是共价化合物,故错误;
故选A.
点评 本题考查离子键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意结合常见的实例解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NH4HCO3溶液和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O | |
| C. | 向FeBr2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯气与Na2SO3溶液反应:Cl2+SO32-+H2O═SO42-+2Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
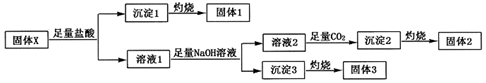
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
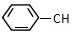 =CHCH3的说法不正确的是( )
=CHCH3的说法不正确的是( )| A. | 分子式为C9H10 | B. | 该有机物的一氯代物有5种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 所有碳原子不可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁酮的催化加氢反应 | B. | 丙酮与HCN发生加成反应 | ||
| C. | 乙醛与乙醛反应生成2-羟基丁醛 | D. | 乙苯与酸性高锰酸钾溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | pH |
| NaF | 7.5 |
| Na2CO3 | 11.6 |
| NaClO | 9.7 |
| NaHCO3 | 8.3 |
| A. | 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO | |
| B. | 水解方程式:F-+H2O?HF+OH-的平衡常数为1×10-13 | |
| C. | 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| D. | 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
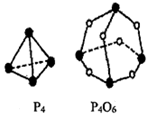 (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表 | 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O <N | Cl <F | NaCl >KBr | HF >HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com