已知可逆反应:M(g)+N(g)?P(g)+Q(g);△H>0,请回答下列问题:
Ⅰ(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L
-1,c(N)=2.4mol?L
-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.
(2)若反应温度升高,M的转化率
增大
增大
(填“增大”“减小”或“不变”).
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L
-1,c(N)=amol?L
-1;达到平衡后,c(P)=2mol?L
-1,a=
6
6
.
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=bmol?L
-1,达到平衡后,M的转化率为
41.4%
41.4%
.
ⅡN
2O
2-是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N
2O
5与苯发生硝化反应生成的硝基苯的结构简式是
.
(2)2N
2O
5(g)→4NO
2(g)+O
2(g);△H>0
①反应达平衡后,若再通入一定量氮气,则N
2O
5的转化率将
不变
不变
(填“增大”、“减小”、“不变”).
②下表为反应在T
1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| e(N2O5)/mol?L-1 |
5.00 |
3.52 |
2.48 |
则500s内N
2O
5的分解速率为
0.00296 mol?L-1?s-1
0.00296 mol?L-1?s-1
.
③在T
3温度下,反应1 000s时测得NO
2的浓度为4.98mol?L
-1,则T
2<
<
T
1.
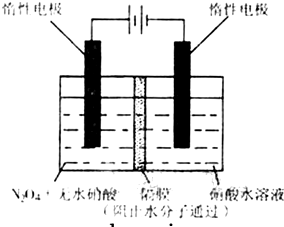
(3)如图所示装置可用于制备N
2O
5,则N
2O
5在电解池的
阳极
阳极
区生成,其电极反应式为
N2O4+2HNO3-2e-=2N2O5+2H+
N2O4+2HNO3-2e-=2N2O5+2H+
.

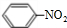
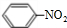

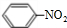 ;
;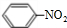 ,故答案为:
,故答案为: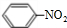 ;
;

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案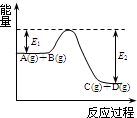 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题: