
| A. | 水的电离是一个吸热过程,温度升高,水的离子积KW也增大 | |
| B. | 当pH减少2个单位时,溶液中c(H+)增大20倍 | |
| C. | pH=2.0的酸溶液,稀释10倍时,pH为3 | |
| D. | 溶液稀释时,c(H+)减少,pH增大 |
分析 A.水的电离是吸热反应,升高温度促进水电离;
B、根据pH=-lgc(H+)来计算;
C、强酸和弱酸的稀释存在不同点,弱酸的稀释会促进电离;
D、酸溶液稀释时,pH增加,但是碱溶液稀释时,pH减小.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,水中氢离子、氢氧根离子浓度都增大,所以离子积常数增大,故A正确;
B、当pH减少2个单位时,溶液中c(H+)增大100倍,故B错误;
C、pH=2.0的强酸溶液,稀释10倍时,pH=3,pH=2.0的弱酸溶液,稀释10倍时,pH<3,故C错误;
D、酸溶液稀释时,酸中c(H+)减少,pH增加,但是碱溶液稀释时,c(H+)增加,pH减小,故D错误.
故选A.
点评 本题考查学生弱电解质的电离以及溶液pH的计算等知识,属于基础知识的考查,难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶解 过滤 蒸发结晶 | B. | 加热 溶解 过滤 | ||
| C. | 溶解 过滤 蒸馏 | D. | 溶解 过滤 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅和氢氧化钠溶液反应 | B. | 二氧化碳通入饱和Na2CO3溶液 | ||
| C. | 镁在二氧化碳中燃烧 | D. | 氯气通入到氯化亚铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者互为同系物 | |
| B. | 聚乙烯是乙烯的缩聚产物 | |
| C. | 二者都能使溴的四氯化碳溶液褪色 | |
| D. | 等质量的乙烯和聚乙烯分别完全燃烧消耗等物质的量的氧气,生成等量的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
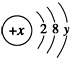 ( y≠0 ).请回答:
( y≠0 ).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
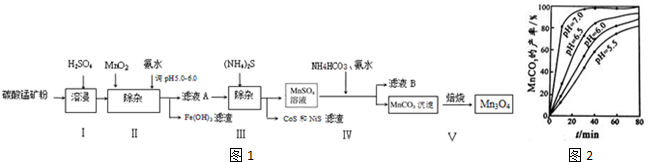
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com