
分析 Ba(OH)2溶液和稀H2SO4溶液反应生成硫酸钡和水;氧化镁和稀硫酸反应反应生成硫酸镁和水,以此来解答.
解答 解:Ba(OH)2溶液和稀H2SO4溶液反应生成硫酸钡和水,反应的离子方程为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
氧化镁和稀硫酸反应反应生成硫酸镁和水,离子反应为MgO+2H+=Mg2++H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;MgO+2H+=Mg2++H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该元素为Mn元素 | B. | 该元素最高化合价为+7 | ||
| C. | 该元素属于d区元素 | D. | 该元素原子最外层共有7个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
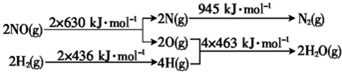
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应②中,反应物的键能大于生成物的键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: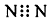 | B. | S2-的结构示意图: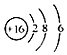 | ||
| C. | HF的电子式: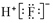 | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
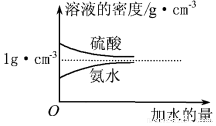
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com