
| A. | 澄清透明的无色溶液:K+、NH4+、MnO4-、HCO3- | |
| B. | 0.10 mol•L-1 KI溶液:Al3+、Fe3+、Cl-、SO42- | |
| C. | 滴入甲基橙变红色的溶液:Na+、Ca2+、NO3-、Cl- | |
| D. | c(H+)=1×10-12 mol•L-1的溶液:Mg2+、Cu2+、NO3-、SO42- |
分析 A.MnO4-为紫色;
B.离子之间发生氧化还原反应;
C.滴入甲基橙变红色的溶液,为酸性;
D.c(H+)=1×10-12 mol•L-1的溶液,显碱性.
解答 解:A.MnO4-为紫色,与无色不符,故A错误;
B.Fe3+、I-发生氧化还原反应,不能共存,故B错误;
C.滴入甲基橙变红色的溶液,为酸性,该组离子之间不反应,可大量共存,故C正确;
D.c(H+)=1×10-12 mol•L-1的溶液,显碱性,不能大量存在Mg2+、Cu2+,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
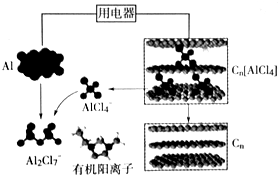
| A. | 充电时,Al做阴极、Cn为阳极 | |
| B. | 充电时,每生成1mol铝,同时消耗4molAl2Cl7- | |
| C. | 放电时,电解质中的有机阳离子向铝电极方向移动 | |
| D. | 放电时,正极反应式为Cn[AlCl4]+e-=Cn+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠投入FeSO4溶液中,可以得到单质铁 | |
| B. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| C. | Na2O与Na2O2中阴阳离子的个数比均为1:2 | |
| D. | 在2Na2O2+2H2O=4NaOH+O2反应中,每生成1molO2,消耗2mol氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
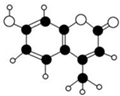 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示.对于该有机物,下列有关叙述正确的是( )| A. | 该物质不能与浓溴水发生取代反应 | |
| B. | 1mol该物质最多能与5mol H2加成 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1mol该物质最多能与含2mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
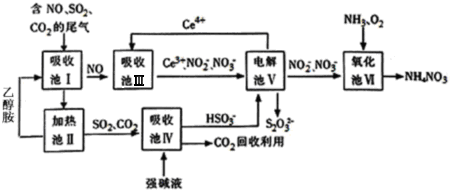
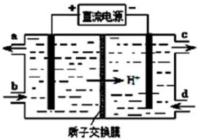
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
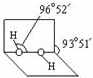 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3═2H++CO32- | B. | NaClO═Na++Cl-+O2- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaOH═Na++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| C. | SO2、SiO2、CO均为酸性氧化物 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com