
| A. | 将20 g NaOH 溶解在500mL 水中 | |
| B. | 将22.4 L HCl 气体溶于水配成1 L 溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9 L 水中 | |
| D. | 将10 g NaOH 溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250 mL |
分析 A.20 g NaOH的物质的量为0.5mol,溶于水配成500mL溶液,所得溶液浓度为1mol/L;
B.HCl不一定处于标况下,22.4L HCl物质的量不一定是1mol;
C.溶液体积不等于浓盐酸与水的体积之和;
D.根据n=cV计算NaOH物质的量,再根据m=nM计算需要NaOH质量.
解答 解:A.20 g NaOH的物质的量为$\frac{20g}{40g/mol}$=0.5mol,溶于水配成500mL溶液,所得溶液浓度为1mol/L,500mL不是溶剂水的体积,故A错误;
B.HCl不一定处于标况下,22.4L HCl物质的量不一定是1mol,故B错误;
C.混合后溶液体积不是10L,故C错误;
D.NaOH物质的量为0.25L×1mol/L=0.25mol,需要NaOH质量=0.25mol×40g/mol=10g,故D正确,
故选:D.
点评 本题考查物质的量浓度及有关计算,比较基础,注意对定义式的理解与灵活应用.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | NO | B. | NO2 | C. | N2O | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023个 | |
| B. | 含1 mol FeCl3的FeCl3饱和溶液完全反应可以生成1mol Fe(OH)3胶体粒子 | |
| C. | 11.2L二氧化碳气体中所含的分子数为0.5NA | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液K+、H+、SO42-、2- | B. | 纯碱溶液K+、SO42-、OH-、NO3- | ||
| C. | 澄清石灰水Na+、Fe3+、CO2、Cl- | D. | 稀硫酸溶液Ba2+、Na+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨转化为金刚石 | |
| B. | Na2O溶于水 | |
| C. | NaCl熔化 | |
| D. | NaOH溶液与盐酸反应生成NaCl和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
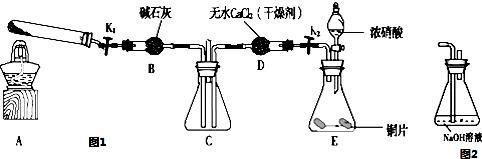
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③④⑤⑥ | D. | 除①②外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com