
| A. | c(OH-)>c(H+) | B. | c(CH3COOH)+c(CH3COO-)=0.2 mol•L-1 | ||
| C. | c(CH3COOH)>c(CH3COO- ) | D. | c(CH3COO- )+c(OH- )=0.2 mol•L-1 |
分析 A.从溶液中的电荷守恒进行分析;
B.根据混合液中的物料守恒判断;
C.CH3COOH和CH3COONa混合溶液,CH3COOH电离程度大于CH3COO-水解程度;
D.根据电荷守恒和醋酸的电离程度分析.
解答 解:A.CH3COOH和CH3COONa混合溶液中,存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),已知c(CH3COO-)>c(Na+),则c(H+)>c(OH-),故A错误;
B.n(CH3COOH)+n(CH3COO-)=0.2mol,溶液体积为1L,则c(CH3COOH)+c(CH3COO-)=0.2mol•L-1,故B正确;
C.CH3COOH和CH3COONa混合溶液,CH3COOH电离程度大于CH3COO-水解程度,则c(CH3COO-)>c(CH3COOH),故C错误;
D.CH3COOH和CH3COONa混合溶液中,存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),醋酸为弱电解质,存在微弱电离,则有
0.1mol/L>c(CH3COOH)>c(H+),c(Na+)=0.1mol/L,则c(CH3COO-)+c(OH-)<0.2mol•L-1,故D错误;
故选B.
点评 本题考查弱电解质和盐类水解问题、离子浓度大小比较,题目难度中等,注意根据溶液电中性和物料守恒解答该题,明确盐的水解原理及其应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚苯乙烯单体的分子式为C8H8 | |
| B. | 聚苯乙烯属于纯净物 | |
| C. | 聚苯乙烯能与溴水发生加成反应 | |
| D. | 聚苯乙烯是可降解塑料,不会造成白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
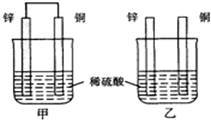
| A. | 两烧杯中溶液的氢离子浓度均减小 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均有气泡产生 | D. | 甲、乙溶液均变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) | |
| B. | 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 | |
| C. | 若误饮c(Ba2+)=1.0×10-5 mol•L-1的溶液时,会引起钡离子中毒 | |
| D. | 可以用0.36 mol•L-1的Na2SO4溶液给钡离子中毒患者洗胃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
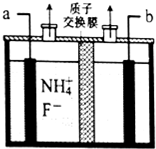 工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示.则a极为阳极,该极的电极反应式NH4++3F--6e-=NF3+4H+,用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法.
工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示.则a极为阳极,该极的电极反应式NH4++3F--6e-=NF3+4H+,用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于覆盖保护层法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:F>O>S | B. | 金属性:Rb>K>Li | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 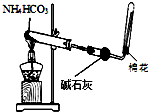 图装置用于制取少量的氨气 | |
| B. | 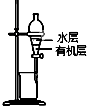 图装置用于提取I2的CCl4溶液中的I2 | |
| C. | 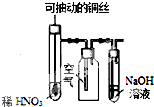 图装置微热稀HNO3,在广口瓶中可收集NO气体 | |
| D. | 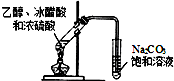 图装置可制取少量的乙酸乙酯 (夹持物略) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 作消毒剂的医用酒精是无水酒精 | |
| B. | 通常状况下,不能与金属钠反应 | |
| C. | 在加热和有银存在下,可与氧气反应生成乙醛 | |
| D. | 在水溶液中能够电离产生H+离子,呈现弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com