
(14分)研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)已知反应:
①2H2(g)+O2(g) 2H2O(g) △H=-483.6 kJ/mol
2H2O(g) △H=-483.6 kJ/mol
②N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
③4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol
则反应④4NH3(g)+3O2(g) 2N2(g)+6H2O(g)的△H=___________。
2N2(g)+6H2O(g)的△H=___________。
(2)在恒温恒容的甲容器,恒温恒压的乙容器中分别进行合成氨反应(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
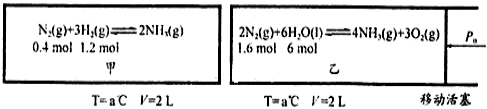
①该条件下甲容器中反应的平衡常数K= ;平衡时,甲容器的压强P = (初始压强用P0表示)。
②该条件下,若向乙中继续加入0.2 mol N2,达到平衡时N2转化率= 。
(3)在实验室中,某同学利用下列试剂及器材完成的实验能够证明NH3·H2O是弱电解质的是_________(选填字母代号)。
A.用氨水做导电性实验,灯泡昏暗
B.将氨水滴入AlCl3溶液中,产生白色沉淀
C.常温下,用pH试纸测得0.1mol/L氨水的pH<13
D.用湿润的蓝色石蕊试纸测得NH4Cl溶液为紫色
(4)常温下,向1molL-1NH4Cl溶液中通入少量的NH3此时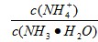 的值 (填“增大”、“减小”或“不变”);若将1molL-1NH4Cl溶液和1molL-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
的值 (填“增大”、“减小”或“不变”);若将1molL-1NH4Cl溶液和1molL-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下图为常温下用0.10mol·L-1NaOH溶液滴定20.00 mL 0.10 mol·L-1盐酸和20.00 mL 0.10 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
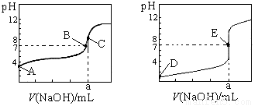
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+)= c(A—)
C.B点时,反应消耗溶液体积:V(NaOH)>V(HA)
D.当0mL<V(NaOH)<20. 00mL时,溶液中一定是c(A-)>c(Na+)>c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:实验题
(本题共12分)某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:

已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
1.写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________。试剂X的名称为______________。
2.加入Z的作用是调节溶液的pH,pH范围应为_____;下列可作为试剂Z的是_______。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
3.实验操作①依次是_________、_________、过滤洗涤即可得硝酸铜晶体。
4.测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是 。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
5.根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________。(用m、n的代数式表示)
6.按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________;____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
液态氨中可电离出极少量的NH2-和NH4+。下列说法正确的是
A.NH3属于离子化合物 B.常温下,液氨的电离平衡常数为10-14
C.液态氨与氨水的组成相同 D.液氨中的微粒含相同的电子数
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
下列化学用语使用正确是
A.氧原子能量最高的电子的电子云图:
B.35Cl与 37Cl互为同素异形体
C.CH4分子的比例模型:
D.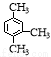 的命名:1,3,4-三甲苯
的命名:1,3,4-三甲苯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
用下列实验装置完成对应的实验,能达到实验目的且合理的是
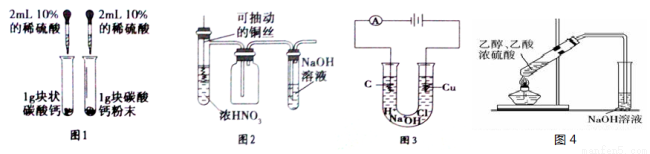
A.用图1所示装置探究反应物接触面积对反应速率影响
B.用图2所示装置制取并收集少量的NO2气体(不考虑倒吸)
C.用图3所示装置制取并收集少量的氯气
D.用图4所示装置制取少量乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:简答题
【化学─选修2:化学与技术】(15分)硫酸工业的废渣回收再利用的工艺流程如下:
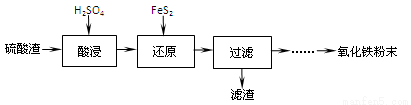
注:硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。“酸浸”后Fe2+可被空气中O2氧化(用离子反应方程式表示) 。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
第一步:氧化: ;(填写具体操作)
第二步:沉淀 ;(填写具体操作)
第三步:分离,洗涤;
第四步:烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:选择题
下列实验不能达到目的的是
A.用分液的方法分离乙醇和乙酸
B.用NaOH溶液除去苯中的溴
C.用NaAlO2溶液和过量盐酸制备Al(OH)3
D.用足量铁粉除去FeCl2溶液中的FeCl3杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com