
| A. | 稳定性:HF>HCl>HBr>HI | B. | 氧化性:I2>Br2>Cl2 | ||
| C. | 沸点:H2O>NH3 | D. | 还原性:HI>HBr>HCl>HF |
分析 A.根据非金属性的递变规律判断;
B、元素的非金属性越强对应单质的氧化性越强;
C、根据范德华力对物质性质的影响结合H2O、NH3中含有氢键分析;
D、根据同主族元素的非金属性越强,对应的氢化物的还原性越弱.
解答 解:A.F、C1、Br、I的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,故A正确;
B、元素的非金属性越强对应单质的氧化性越强,而元素的非金属性Cl>Br>I,所以单质的氧化性I2<Br2<Cl2,故B错误;
C、组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高,H2O、NH3属于分子晶体,但H2O、NH3中都含有氢键,使得沸点变大,每个H2O中含有2个氢键,每个NH3中含有1个氢键,所以氢化物的沸点:H2O>NH3,故C正确;
D、非金属性:Cl>Br>I,同主族元素的非金属性越强,对应的氢化物的还原性越弱,还原性:HI>HBr>HCl,故D正确;
故选B.
点评 本题考查元素周期律的递变规律,题目难度不大,本题注意C项的判断角度,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+ | B. | Na+、Al3+、Mg2+ | C. | Na+、Mg2+、[Al(OH)4]- | D. | Na+、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | 有难溶物存在 |
| 步骤2: | ①有无色气泡产生,说明有CaCO3 ②出现无色气泡,说明含有碳酸钙,说明有若有难溶物存在,说明有二氧化硅 |
| 步骤3: | |
| … |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 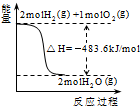 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 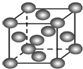 表示Cu形成金属晶体时的堆积方式 表示Cu形成金属晶体时的堆积方式 | |
| C. | 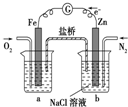 装置中烧杯a中的溶液pH降低 装置中烧杯a中的溶液pH降低 | |
| D. |  装置中待镀铁制品应与电源正极相连 装置中待镀铁制品应与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )| A. | 反应开始时,B池中石墨电极上发生氧化反应 | |
| B. | 反应开始时,A池中石墨电极上I-被还原 | |
| C. | 反应开始时,盐桥中K+由左向右迁移 | |
| D. | 电流计读数为零后,在B池中溶入Na3AsO3固体,B池中的石墨电极为正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com