
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
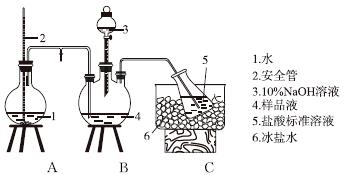
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
(1)当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
(2)碱 酚酞(或甲基红)
(3)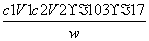 ×100%
×100%
(4)偏低
(5)防止硝酸银见光分解 2.8×10-3
(6)+3 2CoCl2+2NH4Cl+10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
[解析] (1)安全管与大气相通,可通过液体在安全管的上升平衡A瓶内的压强。(2)量取NaOH溶液用碱式滴定管,滴定终点由酸性变到中性,用酚酞作指示剂。(3)根据题给信息可知HCl参与两个反应:氨测定过程中反应为NH3+HCl===NH4Cl,残留HCl与NaOH反应。由氨测定过程中反应的HCl的量可确定氨的量,进而确定氨的质量分数。(4)若气密性不好则会导致氨气逸出,使测量结果偏低。(5)测氯的过程中用硝酸银溶液,而硝酸银见光易分解,故用棕色滴定管;根据溶度积常数和c(Ag+)可计算出c(CrO )。(6)由样品中钴、氨、氯的物质的量之比为1∶6∶3得X的化学式[Co(NH3)6]Cl3,利用化合价规则判断钴的化合价;制备X时用到H2O2,而H2O2在温度过高时会分解,且温度过高溶解的氨也会减小。
)。(6)由样品中钴、氨、氯的物质的量之比为1∶6∶3得X的化学式[Co(NH3)6]Cl3,利用化合价规则判断钴的化合价;制备X时用到H2O2,而H2O2在温度过高时会分解,且温度过高溶解的氨也会减小。


科目:高中化学 来源: 题型:
下列实验方案正确且能达到相应实验预期目的的是

A.制取少量 B. 制取少量NO2 C.比较MnO2、Cl2、 D.探究NH4HCO3
蒸馏水 I2的氧化性 的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应( )
NH3+CO2―→NNNHOOHOH+H2O
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C.属于共价化合物
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化物比还原物多1.75mol,则下列判断正确的是
A.生成42.0LN2(标准状况)
B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol
D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
既可以在强酸性条件下大量共存又能在强碱性条件下大量共存的离子组是 ( )
A Al3+ Na+ NO3- Cl- B K+ Na+ Cl- NO3-
C K+ Na+ Cl- AlO2- D K+ HCO3- SO42- NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com