
科目:高中化学 来源: 题型:
反应SO2(g)+ NO2(g)SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L, NO2(g)的初始浓度仍为2mol/L,则SO2(g)、NO2(g)的转化率变为多少?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷 题型:计算题
反应SO2(g)+ NO2(g) 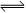 SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平 衡常数。
衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L, NO2(g)的初始浓度仍为2mol/L,则SO2(g)、NO2(g)的转化率变为多少?
查看答案和解析>>
科目:高中化学 来源:2013届山东省济南外国语学校高二上学期期中考试化学(理)试卷 题型:计算题
反应SO2(g)+ NO2(g)
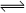 SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L, NO2(g)的初始浓度仍为2mol/L,则SO2(g)、NO2(g)的转化率变为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
反应SO2(g)+ NO2(g) ![]() SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L, NO2(g)的初始浓度仍为2mol/L,则SO2(g)、NO2(g)的转化率变为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com