
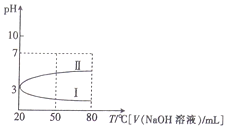
| A. | 0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+) | |
| B. | 向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,溶液pH的变化如曲线II | |
| C. | 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 | |
| D. | 20℃时,0.1mol•L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1 |
分析 A.铝离子水解显酸性抑制铵根离子水解,氢离子是酸抑制铵根离子水解;
B.向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,先生成氢氧化铝沉淀,再和铵根离子结合生成一水合氨,继续滴入生成的氢氧化铝沉淀溶解,据定量关系计算反应过程和溶液pH;
C.升高温度促进铝离子和铵根离子的水解;
D.溶液中存在电荷守恒分析,20°C溶液中离子积常数不知,不能计算氢氧根离子浓度.
解答 解:A.铝离子水解显酸性抑制铵根离子水解,氢离子是酸抑制铵根离子水解,氢离子抑制程度大,所以0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)小于等浓度的NH4HSO4溶液中c(NH4+),故A错误;
B.未加入氢氧化钠溶液,溶液PH=3,向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,物质的量之比为1:4,发生的反应是:Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3•H2O,溶液pH增大,溶液pH的变化如曲线II,故B正确;
C.铝离子和铵根离子的水解过程为吸热反应,升温平衡正向进行,促进水解,故C错误;
D.20℃时,0.1mol•L-1NH4Al(SO4)2溶液中存在电荷守恒,2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),c(H+)=10-3mol/L,2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3mol•L-1-c(OH-),故D错误;
故选B.
点评 本题考查了盐类水解、溶液酸碱性判断、影响水解平衡因素、电解质溶液中电荷守恒分析等,掌握基础是解题关键,题目难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:填空题
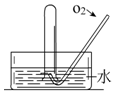 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
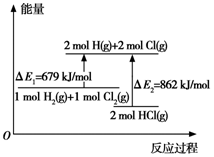
| A. | △E1是该反应的活化能 | B. | △E2是2 mol H-Cl键的总键能 | ||
| C. | 加入催化剂可以改变反应的焓变 | D. | 该反应是一个放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
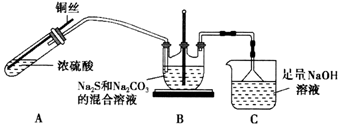
| 序号 | 操作及现象 | 结论 |
| ① | 取少量Al(OH)3粉末于试管中,滴加适量溶液,振荡,白色粉末溶解 | 溶质中一定含有NaOH |
| ② | 取2nL溶液于试管中,滴加足量氯水,氯水褪色丙有气泡产生,再滴加几滴Ba(NO3)2溶液,有白色沉淀产生 | 溶质为NaOH和 Na2CO3、Na2SO3 |
| 取2mL溶液于试管中,若 先加入足量稀硝酸,产生气泡,再滴入几滴Ba(NO3)2溶液,无沉淀产生 | 溶质为为NaOH和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有水分子数为NA | |
| B. | 1mol Na2CO3 固体中含有的钠离子数为NA | |
| C. | 16g O2中含有的氧原子数为NA | |
| D. | 0.1mol/L的NaOH溶液中含有OH-的数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 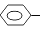 CH=CH2 CH=CH2 | B. | CH2=CH-CN | C. | CH2=CH-C(CH3)=CH2 | D. | CH2=CH-CH=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com