
| A. | Fe3+、F-、Cl- | B. | Mg2+、SO42-、Br- | C. | Mg2+、Cl-、Fe2+ | D. | Na+、NH4+、Cu2+ |
分析 pH=1的溶液为酸性溶液,溶液中存在大量氢离子,
A.氟离子与氢离子结合生成氟化氢;
B.硝酸根离子在酸性条件下具有强氧化性,能够氧化溴离子;
C.硝酸根离子在酸性条件下能够氧化亚铁离子;
D.三种离子之间不反应,都不与氢离子、钡离子、硝酸根离子反应.
解答 解:pH=1的溶液为酸性溶液,溶液中存在大量氢离子,
A.Cl-与氢离子反应生成HF,在溶液中不能大量共存,故A错误;
B.NO3-在酸性条件下能够氧化Br-,在溶液中不能大量共存,故B错误;
C.NO3-在酸性条件下能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.Na+、NH4+、Cu2+之间不反应,且都不与氢离子、Ba2+、NO3-反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 10 m 量筒量取 5.2 mL盐酸 | |
| B. | 用 100 mL量筒量取 5.2 mL盐酸 | |
| C. | 用托盘天平称取25.02g NaCl | |
| D. | 用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:
醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1-丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )
已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )| A. | A是镁,B是碳 | B. | A是碳,B是氢气 | C. | A是铝,B是铁 | D. | A是钠,B是氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- 不可能存在 | B. | 100 mL溶液中含0.01 mol CO32- | ||
| C. | K+一定存在 | D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
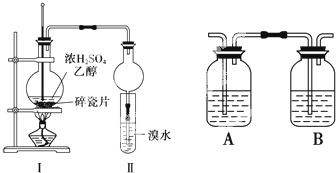 某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com