
| A. | 自然界中的氧气和二氧化碳通过光合作用与呼吸作用可以相互转化 | |
| B. | 实验室制氧气和二氧化碳都可通过分解反应制得 | |
| C. | 氧气和二氧化碳都可以用向上排空气法收集 | |
| D. | 一般情况下,氧气能支持燃烧,二氧化碳不能支持燃烧 |
分析 A.植物光合作用吸收二氧化碳,呼出氧气;
B.高锰酸钾受热分解生成氧气,碳酸钙与盐酸反应生成二氧化碳、氯化钙和水,结合分解反应概念判断;
C.可以用向上排空气法收集的气体密度大于空气密度;
D.根据物质的化学性质来分析.
解答 解:A.在光合作用中,二氧化碳是原料,氧气时产物;在呼吸作用中,氧气是原料,二氧化碳是产物,故A正确;
B.高锰酸钾受热分解生成氧气,属于分解反应,碳酸钙与盐酸反应生成二氧化碳、氯化钙和水,属于复分解反应,不是分解反应,故B错误;
C.二氧化碳、氧气密度大于空气,可以用向上排空气法收集,故C正确;
D.氧气具有助燃性,二氧化碳既不能燃烧也不能支持燃烧,故D正确;
故选B.
点评 本题考查了氧气和二氧化碳的循环、结构以及性质,熟悉相关物质的性质是解题关键,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
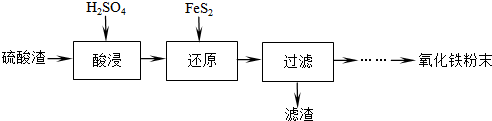
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
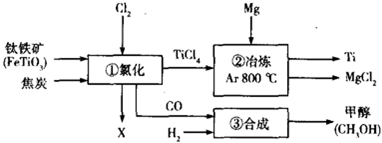
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
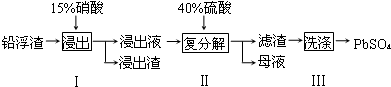
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com