

分析 (1)三价铁离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,据此书写离子反应方程式,根据离子反应方程式计算参加反应的SO2 和Fe3+的物质的量之比;(2)实验室制取气体要考虑操作方便、易控制、不能含杂质;
(3)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;
(4)从A中所得溶液提取晶体为绿矾,溶液中得到绿矾的实验操作是蒸发浓缩,冷却结晶,过滤洗涤,干燥步骤得到;
(5)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(6)B中发生SO2+I2+2H2O=2HI+H2SO4,还原剂的还原性大于还原产物.
解答 解:(1)三价铁离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,二者反应的离子方程式:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+,SO2气体还原Fe3+生成的还原产物是Fe2+,参加反应的SO2 和Fe3+的物质的量之比是1:2,
故答案为:Fe2+;1:2;
(2)A.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸钠,无法得到二氧化硫气体,故A错误;
B.浓硫酸虽具有强酸性,且浓硫酸不挥发,亚硫酸钠溶液与浓硫酸能够反应生成二氧化硫气体,故B正确;
C.固体硫在纯氧中燃烧,操作不容易控制,且无法获得纯净的二氧化硫,故C错误;
D.Cu与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,可知制备二氧化硫,故D正确;
故答案为:BD;
(3)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O,所以装置C的作用为:吸收SO2尾气,防止污染空气,
故答案为:吸收SO2尾气,防止污染空气;
(4)溶液中得到绿矾的实验操作是蒸发浓缩,冷却结晶,过滤洗涤,干燥步骤得到,所以在这一系列操作中没有用到的仪器有石棉网、坩埚,
故答案为:BF;
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以方案①不合理,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色,
故答案为:方案①;因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色;
(6)B中发生SO2+I2+2H2O=2HI+H2SO4,还原剂的还原性大于还原产物的还原性,则I-的还原性弱于SO2,现象为紫色变为无色,
故答案为:B中蓝色溶液褪色.
点评 本题考查了元素化合物性质,试题涉及氧化性还原性强弱比较、性质实验方案的设计与评价等知识,明确掌握浓硫酸的性质、二氧化硫的检验方法等知识为解答本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过量的铁与浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | |
| B. | 次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:Mg2++2HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O | |
| D. | 1mol•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+═Al(OH)3↓+Al3++H2 O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液与胶体:不同的本质原因是能否发生丁达尔效应 | |
| B. | 电解质与非电解质:物质本身的导电性 | |
| C. | 氧化还原反应:反应前后元素化合价是否变化 | |
| D. | 纯净物与混合物:是否仅含有一种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
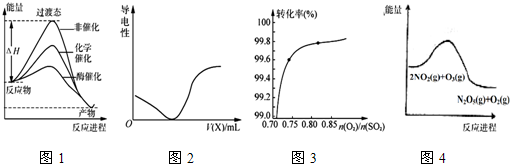
| A. | 由图1所示曲线可知,化学催化比酶催化的效果好 | |
| B. | 在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 | |
| C. | 其它条件不变,关于反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),图3中纵坐标表示O2的转化率 | |
| D. | 图4的反应升高温度,平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 二氧化氯(ClO2)正逐步代替Cl2成为公认的高效、广谱、安全的水处理剂.当自来水厂用ClO2处理后水中含ClO2在0.1~0.8mg•L-1之间时,即达到合格标准.
二氧化氯(ClO2)正逐步代替Cl2成为公认的高效、广谱、安全的水处理剂.当自来水厂用ClO2处理后水中含ClO2在0.1~0.8mg•L-1之间时,即达到合格标准.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com