
 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 5s |
| c2(NO) |
| c(N2)c(O2) |
| c2(NO) |
| c(N2)c(O2) |
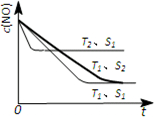 ,故答案为:
,故答案为: .
.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
A、CO2+3H2
| |||
B、6CO2+6H2O
| |||
C、CO2+CH4
| |||
D、2CO2+6H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向裂化汽油中滴加少量酸性高锰酸钾溶液,振荡.若紫红色褪去,即可证明其中含甲苯等苯的同系物 |
| B、选用新制Cu(OH)2悬浊液可以鉴别水、苯、溴苯、乙醛和乙酸 |
| C、采用普通蒸馏装置,将溴的四氯化碳溶液中的溶质与溶剂分离 |
| D、检验某铁粉样品中是否有少量氧化铁杂质,实验步骤为:取少许样品,用盐酸溶解,然后滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示:
(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com