
【题目】50mL浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
【答案】
(1)0.1mol;1120
(2)小于
(3)解:反应后的溶液加入足量的BaCl2溶液,得到沉淀19.81g为BaSO4,其物质的量= ![]() =0.085mol,可知500mL溶液中n(SO42﹣)=0.085mol×
=0.085mol,可知500mL溶液中n(SO42﹣)=0.085mol× ![]() =0.85MOL,根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2)=0.85mol+0.05mol=0.9mol,故原浓硫酸的物质的量浓度=
=0.85MOL,根据S元素守恒可知n(H2SO4)=n(SO42﹣)+n(SO2)=0.85mol+0.05mol=0.9mol,故原浓硫酸的物质的量浓度= ![]() =18mol/L,
=18mol/L,
答:原浓硫酸的物质的量浓度为18mol/L
【解析】解:(1)3.2gCu的物质的量= ![]() =0.05mol,由方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O可知,反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,生成SO2的物质的量=n(Cu)=0.05mol,故生成SO2的
=0.05mol,由方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O可知,反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,生成SO2的物质的量=n(Cu)=0.05mol,故生成SO2的
体积=0.05mol×22.4L/mol=1.12L=1120mL,
所以答案是:0.1mol;1120;(2)50mL a molL﹣1浓硫酸中硫酸的物质的量=0.05L×a molL﹣1=0.05a mol,投入足量的铜片加热,反应中浓硫酸其氧化剂与酸性作用且各占一半,随反应进行浓硫酸变稀,Cu与稀硫酸不反应,故充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.05a mol× ![]() =0.025a mol,所以答案是:小于;
=0.025a mol,所以答案是:小于;


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示. 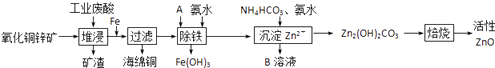
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的 .
A.KMnO4
B.O2
C.H2O2
D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间.
(4)物质B可直接用作氮肥,则B的化学式是 .
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂﹣﹣K2FeO4 , 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁——H2O2酸性电池采用海水作电解质(加入一定量酸),下列说法正确的是( )
A.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2O
B.负极反应为H2O2+2e-+ 2H+= 2H2O
C.电池工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中有很多物质可以实现下图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物. 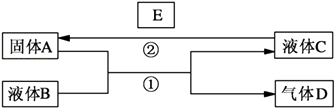
(1)若A是一种红色金属,气体D能使品红溶液褪色,加热时又恢复原色.写出反应①的化学方程式 .
(2)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色.写出反应①的离子方程式;
写出反应②的任意一个离子方程式 .
(3)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液(填“能”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积不变的密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列对于图像分析正确的是
2SO3(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列对于图像分析正确的是

A. 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅲ]氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
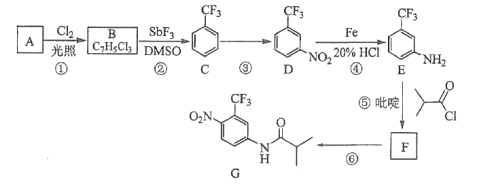
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途,说法错误的是
A.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
B.漂白粉可用于生活用水的消毒
C.二氧化碳可用作镁燃烧的灭火剂
D.Ba2+浓度较高时危害健康,但BaS04可服入体内,作为造影剂用于X射线检查胃肠道疾病
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4L水中所含的分子数约为6.02×1023
B.标准状况下,aL的氧气和氮气的混合物含有的分子数约为 ![]() ×6.02×1023
×6.02×1023
C.常温常压下,48g O3气体含有的氧原子数为6.02×1023
D.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com