
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为_______,Y的轨道表示式为_______;
(2)ZX2的分子式是_______,YX2电子式是_________;
(3)Y与Z形成的化合物的分子式是_______。
【答案】1s22s22p4 ![]() SO2
SO2 ![]() CS2
CS2
【解析】
化合物YX2、ZX2中X、Y、Z的核电荷数小于18,三种元素处于短周期,Y原子的最外层中p能级的电子数等于前一能层电子总数,Y原子只能有2个能层,核外电子排布为1s22s2p2,故Y为C元素;X原子最外能层的p能级中有一个轨道充填了2个电子,外围电子排布为ns2np4,处于ⅥA族,且X和Y具有相同的电子层数,故X为O元素;Z与X在周期表中位于同一主族,则Z为S元素,据此解答。
根据上述分析可知:X是O,Y是C,Z是S元素。
(1)由上述分析可知,X为O元素,其电子排布式为1s22s22p4;Y为C元素,原子核外电子排布为1s22s22p2,故其轨道表示式为:![]() ;
;
(2)由上述分析可知,X是O,Y是C,Z是S,则ZX2的分子式是SO2,YX2为CO2,在CO2分子中C原子与2个O原子之间形成4对共用电子对,使分子中每个原子都达到最外层8个电子的稳定结构,其电子式是:![]() ;
;
(3)Y是C,Z是S,C原子最外层有4个电子,S原子最外层有6个电子,每个C与2个S原子形成4对共用电子对,使分子中每个原子都达到最外层8个电子的稳定结构,故该化合物分子式是CS2。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才消除,如果用草酸(H2C2O4)乙二酸的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+H2C2O4+H+=CO2↑+Mn2++□,下列有关叙述不正确的是( )
A.该反应的氧化剂为KMnO4
B.发生还原反应的是H2C2O4
C.该离子方程式右侧方框内的产生是H2O
D.10molH+参加反应时,电子转移10mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2015年11月首架C919打飞机总装下线,标志着我国跻身飞机研制先进国家行列。
①机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是___(填字母)。
a.密度大 b.硬度大 c.抗腐蚀
②飞机轮胎属于橡胶制品。下列材料可用来合成橡胶的是____(填字母)。
a.石英砂 b.石灰石 c.异戊二烯
③机体先进复合材料的使用率达12%。下列属于复合材料的是___(填字母)。
a.钛合金 b.玻璃钢 c.普通陶瓷
(2)秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:

①属于人体所需微量元素的是____。
②属于水溶性维生素的是____,属于糖类的有阿拉伯果糖、___。
③蛋白质在人体内最终的水解产物是_____。
(3)化学能帮助我们更好地认识生活、改善生活。
①家用铁锅未洗净晾干,放置一段时间后出现红褐色锈斑,其主要的原因是铁发生了____腐蚀。
②乘车禁止携带物品的部分标识如图所示。在浓硝酸、食盐、汽油、石膏四种物品中,不能携带上车的是_____。

③过氧乙酸(![]() )易分解为乙酸和氧气,其稀溶常用于餐具、器械的消毒。写出过氧乙酸分解的化学方程式______。某胃药的主要成分是AlbMgc(OH)mCO3,常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式_______。
)易分解为乙酸和氧气,其稀溶常用于餐具、器械的消毒。写出过氧乙酸分解的化学方程式______。某胃药的主要成分是AlbMgc(OH)mCO3,常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用下列装置和操作,能达到实验目的的是
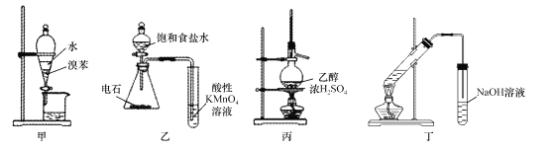
A. 用装置甲分离出溴苯 B. 用装置乙验证乙炔的还原性
C. 用装置丙制取乙烯 D. 用装置丁制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为测定一新配的稀盐酸的准确浓度,通常用纯净的![]() (无水)配成溶液进行滴定。称取W克纯净无水
(无水)配成溶液进行滴定。称取W克纯净无水![]() 装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
(1)由于![]() 溶在溶液中会影响pH,为准确滴定,终点pH宜选在4~5之间,应选用以下三种指示剂中的____。(填序号)
溶在溶液中会影响pH,为准确滴定,终点pH宜选在4~5之间,应选用以下三种指示剂中的____。(填序号)
A.石蕊 B.甲基橙 C.酚酞
(2)滴定达到终点时溶液的颜色变化是________。写出上述滴定反应的离子方程式:_______。
(3)若达到滴定终点时,W克![]() 消耗盐酸V毫升,则盐酸的物质的量的浓度为________mol/L。
消耗盐酸V毫升,则盐酸的物质的量的浓度为________mol/L。
(4)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“![]() ”反应中
”反应中![]() 和
和![]() 的相互转化。实验如下:
的相互转化。实验如下:
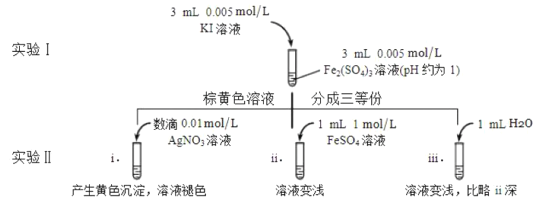
①待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ,目的是使实验Ⅰ的反应达到_______。
②iii是ii的对比实验,目的是排除有ii中______造成的影响。
③i和ii的颜色变化表明平衡___移动(填写“正向”或“逆向”或“不”)。用化学平衡移动原理解释原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为_______________;
(2)Y元素原子的价层电子的轨道表示式为_____________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G7种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素。
(1)A的名称是____________,B位于周期表中第_________周期________族,C的原子结构示意图是________________。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成的化合物的电子式是__________________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是________(填化学式,下同),酸性最强的是_______________,气态氢化物最稳定的是______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭.导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。
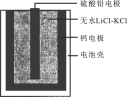
下列有关说法正确的是
A .正极反应式:Ca+2Cl- - 2e- =CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针不偏转
D.每转移0.1mol电子,理论上生成20.7g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)赤水晒醋是我们遵义特产之一,其中含有一定量的CH3COOH。写出CH3COOH的电离方程式 ______;在已达平衡的乙酸溶液中加入一定的CH3COONa ,该溶液pH_______(填“增大”“减小”或“不变”)。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是___________;负极反应是____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是__________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是___________。
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s) ![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是_____(填写序号);其中②中氯离子的浓度为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com