
| A. | 7.8g | B. | 15.6g | C. | 3.9g | D. | 78g |
分析 n(NaOH)=2mol/L×0.35L=0.7mol,n(Al3+)=2n[Al2(SO4)3]=2×0.1mol=0.2mol,硫酸铝与氢氧化钠会发生反应:Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,如果铝离子完全转化为沉淀需要0.6molNaOH,剩余0.1molNaOH溶解氢氧化铝沉淀,据此分析解答.
解答 解:0.1molAl2(SO4)3溶液中n(Al3+)=0.1mol×2=0.2mol,
350mL 2mol/L NaOH溶液中n(OH-)=0.35L×0.2mol/L=0.7mol,
n(Al3+):n(OH-)=0.2mol:0.7mol=1:3.5,介于1:4与1:3之间,故发生为:Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,
令生成氢氧化铝的物质的量为xmol,则:
Al3++3OH-=Al(OH)3↓,
x 3x x
Al3++4OH-=AlO2-+2H2O,
0.2-x 0.7-3x
所以0.7-3x=4(0.2-x),
解得x=0.1,
故生成氢氧化铝的质量=0.1mol×78g/mol=7.8g;
故选A.
点评 本题考查化学反应方程式有关计算,侧重考查学生分析能力和计算能力,正确判断产物成分是解本题关键,注意关系式的灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
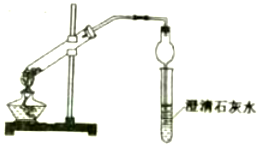 现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别:
现有两瓶白色固体分别是碳酸钠固体与碳酸氢钠固体,某同学利用多种方法进行鉴别:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40.75 | B. | 29.38 | C. | 14.69 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验一 | 实验二 | |
| 装置 | 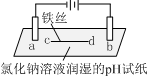 | 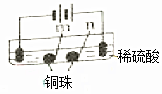 |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-=H2↑+2OH- | |
| B. | b处:2Cl--2e-=Cl2↑ | |
| C. | 根据实验一的原理,实验二中m处能析出铜 | |
| D. | n处发生了反应:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2分子由1个硅原子和2个氧原子组成 | |
| B. | 水晶的主要成分是单质硅 | |
| C. | 太阳能电池可采用SiO2制作,其应用有利于节能、环保 | |
| D. | 水玻璃可用作黏合剂和木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5mol C2H6分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA | |
| D. | 1mol甲基-CH3所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 湿润的淀粉碘化钾试纸遇氯气变蓝色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va:Vb=9:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
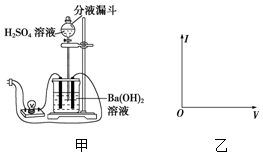 使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:
使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com