
两体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 |
| B.正反应是吸热反应 |
| C.t3时刻可能是增大了压强 |
| D.t3时刻可能是降低了温度 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:单选题
某反应其△H="=" -122 kJ/mol,?S="=" 231 J/(mol·K),则此反应在下列哪种情况下可自发进行
| A.在任何温度下都能自发进行 | B.在任何温度下都不能自发进行 |
| C.仅在高温下自发进行 | D.仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | | | |
| t2 | | 0.20 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,把3molA和2.5molB混合,盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) xC(气)+2D(气)
xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1。下列叙述不正确的是
| A.x的值为2 |
| B.B的转化率为20% |
| C.平衡常数为1/3 |
| D.A的平均消耗速率为0.15mol·L-1·min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
下列叙述正确的是
| A.点a的正反应速率比点b的小 |
| B.点 c处反应达到平衡 |
| C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用勒夏特列原理解释的是
| A.配制氯化铁溶液时,加入少量稀盐酸 |
| B.配制氯化亚铁溶液时,加入少量铁屑 |
| C.在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 |
| D.在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)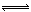 2SO3(g) △H<0,n(SO2)随时间的变化如表:
2SO3(g) △H<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,C(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0;
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka?Kb=Kw
⑥若反应A(g)="2" B (g) 正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应,在10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com