
分析 (1)任何电解质溶液中都存在OH-、H+,如果溶液中只存在一种溶质,根据溶液中存在的离子知,溶质只能是氯化铵,NH4+水解导致其溶液呈酸性,但水解程度较小;
(2)若上述关系中④是正确的,c(OH-)>c(H+)则溶液呈碱性,氯化铵溶液呈酸性,要使混合溶液呈碱性,则溶液中溶质为一水合氨和氯化铵;
(3)该溶液中由体积相等的稀盐酸和氨水混合而成,溶液呈中性,根据电荷守恒分析.
解答 解:(1)溶液中只存在OH-、H+、NH4+、Cl-四种离子,任何水溶液中均存在OH-和H+,所以去掉OH-和H+,剩下的离子就是溶质产生的,因此①中溶质为氯化铵
可能为NH4Cl溶液,因NH4+水解而显酸性,溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:氯化铵;A;
(2)若上述关系中④是正确的,c(OH-)>c(H+)则溶液呈碱性,氯化铵溶液呈酸性,要使混合溶液呈碱性,溶液中一水合氨电离程度大于铵根离子水解程度,所以该溶液中溶质为NH4Cl、NH3•H2O,
故答案为:NH4Cl、NH3•H2O;
(3)溶液呈中性,据c(Cl-)+c(OH-)=c(NH4+)+c(H+)可得c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水浓度大于盐酸浓度,如小于或等于,则溶液呈酸性,
故答案为:<;=.
点评 本题综合考查盐类的水解、弱电解质的电离以及离子浓度的大小比较,题目难度中等,注意把握盐类的水解以及弱电解质电离的特征,把握比较离子浓度大小顺序的方法.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
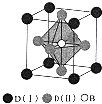 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+(用离子方程式表示);
NH3•H2O+H+(用离子方程式表示); Ca2+(aq)+CuA(s).
Ca2+(aq)+CuA(s).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中离子数目增加,导电性增强 | |
| B. | 加水促进醋酸电离,但[H+]、[OH-]均减小 | |
| C. | 加水稀释到1000 mL,溶液的pH=5 | |
| D. | $\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中水电离出c(OH-)=1.0×10-10mol•L-1 | |
| B. | 所得溶液中的c(Cu2+)=1.0×10-5mol•L-1 | |
| C. | 向所得溶液中滴加Na2S溶液会有黑色沉淀出现 | |
| D. | 除去工业废水中的Cu2+,可以用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH=4 | |
| B. | 升高温度,溶液的pH增大 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 若要使HA的电离平衡向左移动且溶液的pH值减小,可以在溶液中通入HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com