
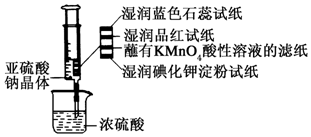
 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸只变红不褪色 | |
| B. | 湿润的品红试纸蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2不能将I-还原为I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
分析 浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫为酸性氧化物与水反应生成亚硫酸,具有酸性,能够与氢氧化钠反应生成亚硫酸钠和水;二氧化硫具有强的还原性能够被酸性的高锰酸钾、卤素单质氧化,二氧化硫具有漂白性,能够使品红褪色,但是不能漂白指示剂,由此分析解答.
解答 解:A.SO2只能使蓝色石蕊试变红,但不能漂白指示剂,故A正确;
B.二氧化锰能够使酸性高锰酸钾褪色体现的是二氧化硫的还原性,与漂白性无关,故B错误;
C.氧化还原反应中氧化性:氧化剂>还原剂,湿润的碘化钾淀粉试纸末变蓝说明SO2不能将I-氧化为I2,故C错误;
D.二氧化硫有毒,不能直接排放到空气中,可与NaOH溶液反应生成盐和水,所以NaOH溶液可用于除去实验中多余的SO2,故D正确;
故选:AD.
点评 本题以实验为载体,考查了二氧化硫的性质,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1mol H2在O2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
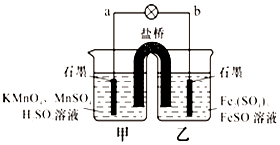 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A. | 外电路的电流方向是从a到b | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 乙烧杯中发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝镁合金的硬度较大,钠钾合金常温下为液态 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酚酞试液从无色变为红色 | B. | 钠安静地浮在水面上 | ||
| C. | 钠熔化成光亮的小球 | D. | 钠在水面上到处游动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com