
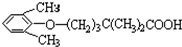 是常用的降血脂药物之一.下列有关它的说法正确的是( )
是常用的降血脂药物之一.下列有关它的说法正确的是( )A、它是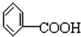 的同系物 的同系物 |
| B、它能发生加成、取代、消去等反应 |
| C、它可使酸性KMnO4溶液褪色,但不能与溴水反应使其褪色 |
| D、它苯环上的一氯代物有三种 |
科目:高中化学 来源: 题型:
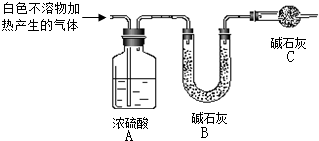 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为 |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 | 白色不溶物中含有MgCO3 | |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 |
| B、人们常采用牺牲阳极保护法防止通讯电缆发生腐蚀 |
| C、在电镀槽中,镀件做阴极,阳极选用镀层金属 |
| D、用惰性电极电解某硫酸铜溶液一段时间后,要恢复溶液的成分和浓度,可向溶液中加入一定量的氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
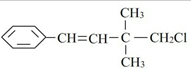
| A、不能使酸性KMnO4溶液褪色 |
| B、不能发生取代反应 |
| C、在加热和催化剂作用下,最多能和4 mol H2反应 |
| D、一定条件下,能和NaOH醇溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
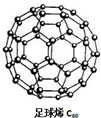 C60可用作储存氢气的材料,结构如图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A、C60、Si60、N60都属于原子晶体 |
| B、C60、Si60、N60分子内共用电子对数目相同 |
| C、由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D、由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N5+有24个电子 |
| B、N5+离子中存在三对未成键的电子对 |
| C、N5+阳离子中存在两个氮氮三键 |
| D、N5+在水中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解质的水溶液中存在电离平衡.
电解质的水溶液中存在电离平衡.| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol?L-1 AgNO3溶液中加入2mL 0.005mol?L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol?L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol?L-1AgNO3溶液. | |
| 步骤4:向步骤1余下的浊液中加入5滴3mol?L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、松花蛋是一种常用食品,食用时有氨的气味,可以蘸些食醋除去 |
| B、“皮革奶”是奶粉中掺入皮革下脚料,将皮革灼烧时有烧焦羽毛的气味 |
| C、腌制食品中应严格控制NaNO2的用量 |
| D、从海水中可提取Mg,用惰性电极电解熔融的MgCl2或其水溶液都可制得Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com