
 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:分析 (1)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
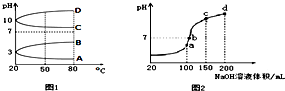
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故答案为:小于;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为A,故答案为:A;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1[c(OH-)太小,可忽略],故答案为:10-3;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查盐类的水解和离子浓度大小的比较,为高频考点,侧重考查学生的分析能力,题目难度较大,(2)②为易错点,注意根据守恒思想解题.


科目:高中化学 来源: 题型:多选题
| 选项 | 需除杂的物质 | 试剂 |
| A | Fe(Al) | NaOH溶液 |
| B | CO2(HCl) | NaOH溶液 |
| C | NaCl(Na2CO3) | 稀硫酸 |
| D | NH3(H2O) | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
| A. | -1928 | B. | +1928 | C. | +1838 | D. | -1838 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、HS-NO3- | B. | Al3+、Cl-、HCO3-、Na+ | ||
| C. | AlO2-、K+、CO32-、Na+ | D. | Fe2+、K+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体无色、透明,能产生丁达尔效应 | |
| B. | SO3溶于水后得到的溶液可以导电,但SO3是非电解质 | |
| C. | 硫酸溶液的导电性一定比醋酸溶液的导电性强 | |
| D. | 用萃取分液的方法除去酒精中的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | F2和Cl2 | B. | F2和Br2 | C. | Cl2和Br2 | D. | Br2和I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com