
| A. | $\frac{4}{5}$v (NH3)=v (O2) | B. | $\frac{5}{6}$v (O2)=v (H2O) | C. | $\frac{3}{2}$v (NH3)=v (H2O) | D. | $\frac{5}{4}$v (O2)=v (NO) |
分析 同一化学反应中,不同物质表示的化学反应速率之比等于其化学计量数之比.
解答 解:对于反应4NH3+5O2═4NO+6H2O,
A.速率之比等于化学计量数之比,故υ(NH3):υ(O2)=4:5,即υ(O2)=$\frac{5}{4}$υ(NH3),故A错误;
B.速率之比等于化学计量数之比,故υ(O2):υ(H2O)=5:6,即υ(H2O)=$\frac{6}{5}$υ(O2),故B错误;
C.速率之比等于化学计量数之比,故υ(NH3):υ(H2O)=4:6,即υ(H2O)=$\frac{3}{2}$υ(NH3),故C正确;
D.速率之比等于化学计量数之比,故υ(O2):υ(NO)=5:4,即υ(NO)=$\frac{4}{5}$υ(O2),故D错误,
故选C.
点评 本题考查化学反应速率规律,明确同一化学反应中,用不同的物质来表示化学反应速率数值可能不同,但意义相同,且化学反应速率之比等于化学计量数之比.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化剂是CN- | |
| B. | 现取1 L含CN-1.02 mg/L的废水,至少需用4.0×10-5mol Cl2处理后才符合排放标准 | |
| C. | 若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol | |
| D. | 当有0.4 mol CO2生成时,反应中转移的电子的总数目约为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe粉加入稀盐酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
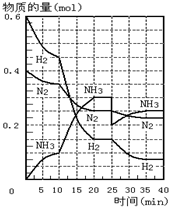 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它们的物质的量相等时,跟足量的盐酸反应,在相同状况时放出的CO2体积相同 | |
| B. | 它们的物质的量相等时,跟足量的盐酸反应,所消耗盐酸的物质的量相同 | |
| C. | 它们的物质的量相等时,在水中电离出相同数目的Na | |
| D. | 它们的物质的量相等时,与足量盐酸反应产生物质的量相等的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com