
| A. | 碳酸钠可以用于治疗胃酸过多 | |
| B. | 过氧化钠可做航天员的供氧剂 | |
| C. | 金属钠有强还原性,能和硫酸铜溶液反应,但不能析出金属铜 | |
| D. | 为使面包松软可口可用碳酸氢钠做发泡剂 |
分析 A、碳酸钠碱性较强,具有腐蚀性;
B、过氧化钠与二氧化碳、水会生成氧气;
C、钠与盐溶液反应时,先与水反应;
D、碳酸氢钠受热分解生成气体.
解答 解:A、碳酸钠碱性较强,具有腐蚀性,不能用于治疗胃酸过多,可以用碳酸氢钠和氢氧化铝,故A错误;
B、过氧化钠能与航天员呼出的二氧化碳、水反应生成氧气,所以过氧化钠可做航天员的供氧剂,故B正确;
C、钠与盐溶液反应时,先与水反应,则Na和硫酸铜溶液反应时先生成氢氧化钠,氢氧化钠再与硫酸铜反应生成氢氧化铜沉淀,不能析出金属铜,故C正确;
D、碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,有气体生成,所以为使面包松软可口可用碳酸氢钠做发泡剂,故D正确.
故选A.
点评 本题考查了元素及其化合物的知识,明确物质的性质是解答本题的关键,题目难度不大,侧重于化学知识在生产生活中应用的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
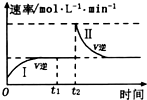 在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0; t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示.下列说法中,一定不正确的是( )
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0; t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示.下列说法中,一定不正确的是( )| A. | 0~t1时,V正>V逆 | |
| B. | I、Ⅱ两过程分别达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| C. | t2时刻改变的条件可能是向密闭容器中加C物质 | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ=Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe3+与的物质的量之比为1:3 | |
| C. | 混合物里FeO的物质的量无法确定,但Fe和Fe2O3的物质的量多 | |
| D. | 混合物里Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| B. | 硅是构成矿石和岩石的主要元素,硅在地壳中的含量在所有元素中居第二位 | |
| C. | 单晶硅常用于制造光导纤维 | |
| D. | 可用石英坩埚加热NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- | |
| B. | 某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- | |
| C. | 某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ | |
| D. | 某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡在溶液中反应:Ba2++SO42-═BaSO4↓ | |
| B. | 少量金属钠投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ | |
| C. | BaCO3与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 用Cl2将苦卤中的Br-氧化:Cl2+2Br-═2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2是还原产物,且还原剂与氧化剂物质的量之比是2:3 | |
| B. | N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3 | |
| C. | 每转移6mol电子就生成22.4LN2 | |
| D. | NH4Cl是氧化产物,且还原剂与氧化剂物质的量之比是2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com