
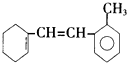
| A. | 分子式为C15H18 | |
| B. | 能使酸性KMnO4溶液褪色,且是氧化反应 | |
| C. | 1mol该物质最多和2molH2加成 | |
| D. | 苯环上的一氯化物有4种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| 性质 | 金刚石 | 石墨 |
| 外观 | 无色,透明固体 | 灰黑,不透明固体 |
| 沸点 | ? | ? |
| 熔点 | ? | ? |
| 燃烧热/kJ•mol-1 | 395.4 | 393.5 |
| A. | C(石墨,s)═C(金刚石,s)△H=+1.9kJ•mol-1 | |
| B. | 在相同条件下石墨的熔点应高于金刚石 | |
| C. | 金刚石中碳碳键键能大于石墨中碳碳键键能 | |
| D. | 在相同条件下石墨和金刚石的沸点应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
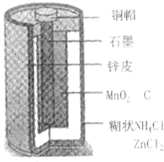 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 2.4gMg溶于足量稀盐酸,转移的电子数为0.1NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
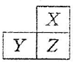 X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物的热稳定性:X<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | X和Z形成的化合物只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4gNH3中含有电子数为2NA | |
| B. | 0.1mol/L CuSO4溶液中含有的SO2-4数目为0.1NA | |
| C. | 常温常压下,2.24L O3中含有的氧原子数为0.3NA | |
| D. | 8.7gMnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的氯分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
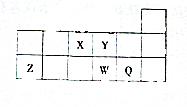 短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示
短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示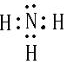 ,其水溶液呈碱性性(填酸、碱或中)
,其水溶液呈碱性性(填酸、碱或中)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com