
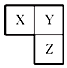
 X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )| A. | 在三种元素形成的简单气态氢化物中,Y的气态氢化物沸点最高 | |
| B. | Z元素的氧化物对应的水化物一定是一种强酸 | |
| C. | 三种元素原子半径的大小顺序为:X>Y>Z | |
| D. | Z的单质与Fe反应生成的化合物中,铁元素显+3价 |
分析 由X、Y、Z三种短周期元素在周期表中的相对位置,Y为第二周期元素,Y原子的最外层 电子数是次外层电子数的3倍,则Y的最外层电子数为6,Y为O元素,结合位置可知,X为N,Z为S,以此来解答.
解答 解:由上述分析可知,X为N,Y为O,Z为S,
A.氨气、水分子间均含氢键,但水分子间氢键多,则三种元素形成的简单气态氢化物中,Y的气态氢化物沸点最高,故A正确;
B.Z元素的氧化物对应的水化物,若为亚硫酸,为弱酸,故B错误;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小,则三种元素原子半径的大小顺序为:Z>X>Y,故C错误;
D.Fe与S反应生成FeS,Fe元素为+2价,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题

| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等 | |
| B. | 步骤②中体现了溴易挥发的性质 | |
| C. | ①-④目的是为了富集溴元素 | |
| D. | 步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的气化都是发生了化学变化 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| D. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L | B. | 1 L | C. | 0.5L | D. | 3L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3溶液中滴入稀硫酸有淡黄色沉淀产生:S2O32-+2H+=H2O+SO2↑+S↓ | |
| B. | 用石墨作电极电解AgNO3溶液:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$ 4Ag+O2↑+4H+ | |
| C. | 向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq) | |
| D. | 用食醋除去水壶中的水垢(CaCO3):2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com