
| A. | NH3、BF3两分子都是极性分子 | |
| B. | NH3、BF3两分子的中心原子采取的都是sp3杂化 | |
| C. | 形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道 | |
| D. | 形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道 |
分析 A.对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子;
B.中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数;
C.NH3中N原子有孤对电子,BF3中B原子有空轨道;
D.NH3•BF3中B原子有空轨道,N原子有孤电子对.
解答 解:A.NH3中元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子,BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子,故A错误;
B.NH3中氮原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp3杂化,BF3中B形成3个δ键,无孤电子对,B原子杂化轨道数=σ键数+孤对电子对数=3+0=3,所以采取sp2杂化,故B错误;
C.NH3•BF3中B原子有空轨道,N原子有孤电子对,所以NH3提供孤电子对,BF3提供空轨道,形成配位键,故C正确;
D.NH3•BF3中B原子有空轨道,N原子有孤电子对,所以NH3提供孤电子对,BF3提供空轨道,形成配位键,使B、N原子都达到8电子稳定结构,故D错误;
故选C.
点评 本题考查了分子空间构型、分子极性、配位键等,难度不大,答题时注意B和N最外层电子数,是易错点.


科目:高中化学 来源: 题型:选择题
| A. | pH>7,且c(OH?)>c(K+)>c(H+)>c(CH3COO?) | B. | pH>7,且c(K+)+c(H+)=c(CH3COO?)+c(OH?) | ||
| C. | pH<7,且c(CH3COO?)>c(H+)>c(K+)>c(OH?) | D. | pH=7,且c(CH3COO?)=c(K+)>c(H+)=c(OH?) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性强弱:CI-<Br一<I - | B. | 微粒半径大小:S>Na+>O2- | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 碱性:KOH>NaOH>LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
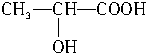
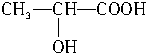 +NaHCO3→
+NaHCO3→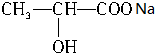 +CO2↑+H2O
+CO2↑+H2O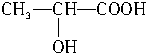 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$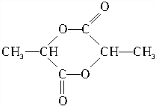 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气反应生成一氯甲烷,其反应类型与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者都属于低聚糖 | |
| C. | 等质量的丙醇和乙酸完全燃烧时所需氧气的质量相同 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和NH3均是价电子总数为8的分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CO2的电子式为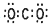 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水滴进碱石灰里可制得氨气 | |
| B. | 蘸浓氨水和蘸浓硫酸的玻璃棒靠近会冒白烟 | |
| C. | 锌片与稀硝酸反应可制得氢气 | |
| D. | 铜片与浓硝酸反应可制得一氧化氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com