
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ������A2(g)��3B2(g)![]() 2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������������ͼ�ɵó����жϽ��۲���ȷ���ǣ� ��
2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������������ͼ�ɵó����жϽ��۲���ȷ���ǣ� ��
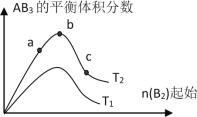
A.��Ӧ����c��b��a
B.�ﵽƽ��ʱA2��ת���ʴ�СΪ��b��a��c
C.��T2��T1��������Ӧһ�������ȷ�Ӧ
D.�ﵽƽ��ʱ��AB3�����ʵ�����СΪ��c > b > a
���𰸡�B
��������
��ͼ��֪��B2��ʼ��ͬʱ��T2��Ӧ��AB3�ĺ���������������ӦΪ���ȷ�Ӧ����T2��T1����������ӦΪ���ȷ�Ӧ����T2��T1����ͼ��֪B2Խ�ﵽƽ��ʱA2��ת����Խ����b��AB3��������������Ӧ������ʵ���֮�Ƚӽ����ڻ�ѧ������֮�ȣ��Դ������
A������ͼ���֪��a��b��c������B����ʼ���ʵ�������������Ӧ���Ũ����������Ӧ������������A��ȷ��
B������ͼ���֪��a��b��c������B����ʼ���ʵ������������ڿ��淴Ӧ��˵������һ�ַ�Ӧ������ʵ�����Ũ�ȣ�������ƽ��������Ӧ�����ƶ�������һ�ַ�Ӧ���ת����������ﵽƽ��ʱA2��ת���ʴ�СΪ��a��b��c����B����
C����T2��T1����ͼ���֪�¶���������������ʵ�������˵�������¶�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ����C��ȷ��
D�����ڿ��淴Ӧ��˵������һ�ַ�Ӧ������ʵ�����Ũ�ȣ�������ƽ��������Ӧ�����ƶ�������������ʵ������࣬���Դﵽƽ��ʱ��AB3�����ʵ�����СΪc��b��a����D��ȷ��
�ʴ�ΪB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25�桢101kPa�����£�C��s����H2��g����CH3COOH��l����ȼ���ȷֱ�Ϊ393.5kJ/mol��285.8kJ/mol��870.3kJ/mol����2C(s)+2H2(g)+O2(g)=CH3COOH(l)�ķ�Ӧ��Ϊ
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S��һ�־綾���壬��ҵ�����п���ͨ�������ֶζ�����л��ջ������á�
��.900��ʱ�����ÿ���˹������H2S���壬�ù������漰�IJ��ַ�Ӧ���£�
��2H2S(g)+O2(g)![]() S2(g)+2H2O(g) ��H=-316.8kJmol-1
S2(g)+2H2O(g) ��H=-316.8kJmol-1
��2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ��H=-1040.2kJmol-1
(1)4H2S(g)+2SO2(g)![]() 3S2(g)+4H2O(g)����H=___
3S2(g)+4H2O(g)����H=___
(2)����900�����Ͼ��ȡ����ݵ��ܱ������У�Ͷ��һ������H2S��O2������Ӧ��������˵����˵����Ӧ�ﵽƽ��״̬����___
a.��������ܶȲ���ʱ��仯���仯
b.v��(O2)=2v��(H2O)
c.��ϵѹǿ����ʱ��仯���仯
d.��Ӧ��ϵ�¶Ȳ���
e.�������ƽ����Է�����������
f.��λʱ��������nmolS2��ͬʱ����2nmolH2S
��.��ҵ�ϻ�����ͨ������ֽ������д��������ã�2H2S(g)![]() S2(g)+2H2(g)����2.0L�����ܱ������г���0.1molH2S����ͬ�¶��²��H2S��ת������ʱ��Ĺ�ϵ��ͼ1��ʾ��
S2(g)+2H2(g)����2.0L�����ܱ������г���0.1molH2S����ͬ�¶��²��H2S��ת������ʱ��Ĺ�ϵ��ͼ1��ʾ��

(3)950��ʱ��0��1.25s����S2(g)��ƽ����Ӧ����Ϊ___
(4)�÷�Ӧ����H___0(������������������=��)��1050���ﵽƽ��ʱH2S��ת����Ϊ35%������¶��£�ƽ�ⳣ��K=___(����һλ��Ч����)�����¶���Q��ʱ��Ӧ___(���������ƶ����������ƶ����������ƶ���)
��.��H2S�����������õ���һ��;���ǽ�����Ƴ�����Ĥ��H2Sȼ�ϵ�أ���Ӧԭ��Ϊ2H2S(g)+O2(g)�TS2(s)+2H2O(l)����ؽṹʾ��ͼ��ͼ2��
(5)�缫a�Ϸ����ĵ缫��ӦʽΪ___��
(6)��NAΪ����٤��������ֵ������·��ͨ��3mol����ʱ��ͨ������Ĥ����___(������������������������)��H+��ĿΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH2C2O4����һ�ֶ�Ԫ���ᡣ����ʱ������ָ����Һ�������ʵ���Ũ�ȹ�ϵ��ȷ����
A.0.1 mol��L1 NaHC2O4��Һ��c(Na��)��c(C2O![]() )��c(HC2O
)��c(HC2O![]() )
)
B.0.1 mol��L-1 Na2C2O4��Һ��c(OH��) = c(H��) + 2c(H2C2O4) + c(HC2O![]() )
)
C.0.1 mol��L1 H2C2O4��Һ��0.2 mol��L1 + c(OH��) = c(H��) + 2c(H2C2O4) + c(HC2O![]() )
)
D.��Na2C2O4��Һ�еμ�H2C2O4��Һ�����ԣ�c(Na��) = 2c(C2O![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ϡ�����ͭ�ܷ�����Ӧ����������ͭ��һ�����������ˮ��
(1)��д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ŷ������Ӧ�е���ת�Ƶķ������Ŀ��________
(2)һ��ʵ���У�ijͬѧ�ù�����ϡ���ᣨ���ܶ�Ϊ1.08 g��mL-1��HNO3����������Ϊ12%����һ������ͭƬ��Ӧ�������˱�״����0.56 L��һ���������Լ��㣨��Ҫд��������̣���
�ٸ�ϡ��������ʵ���Ũ�ȣ��������С�����һλ����______________
�ڱ���ԭ��HNO3�����ʵ�����________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L�����ܱ������г���X(g)��Y(g)��������ӦX(g)+Y(g)![]() M(g)+N(g)������ʵ���������±���
M(g)+N(g)������ʵ���������±���
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(X) | n(Y) | n(M) | ||
�� | 700 | 0.10 | 0.10 | 0.09 |
�� | 800 | 0.20 | 0.20 | 0.10 |
�� | 800 | 0.20 | 0. 30 | a |
�� | 900 | 0.10 | 0.15 | b |
����˵���������
A. ʵ����У���5minʱ���n(M) =0.05mol����0��5minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N) =0.01 mol/( L��min)
B. ʵ����У��÷�Ӧ��ƽ�ⳣ��K= 1.0
C. ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ����У��ﵽƽ��ʱ��b>0.06
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C���ֲ�����ˮ�Ĺ��塣A��ijԪ�ص�һ�ֵ��ʣ�������������ȫȼ�յõ�һ����ɫ���壬��������ʹ����ʯ��ˮ����ǣ����������������ܶ�Ϊͬ�¡�ͬѹ�������ܶȵ�1.375����B����������������������Һ������������Һ�м����������ʱ��������ɫ��״����D���˳��������Ϊ������ˮ�İ�ɫ��ĩ������һ�ֱ�̼�����Ի������ᡣ��B��ʯ��ʯ�����������ϼ��ȵõ�C��C�ڸ���ʱ�������̶��۵㡣
��1������������ʵ���γɵ���A��Ԫ������Ϊ__�� C������Ϊ__��
��2��B��������������������Һ�Ļ�ѧ����ʽ��__��
��3�����ɰ�ɫ��״����D�Ļ�ѧ����ʽ��__��
��4����B��ȡC�Ļ�ѧ����ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ĵ�������Ӧ��2SO2��g��+O2��g��![]() 2SO3��g���ǹ�ҵ��������Ҫ��Ӧ��
2SO3��g���ǹ�ҵ��������Ҫ��Ӧ��
��1����ƽ��Ƕȷ������ù���O2��ԭ����_____��
��2��ij�¶��£�SO2��ƽ��ת���ʣ�![]() ������ϵ��ѹǿ��P���Ĺ�ϵ��ͼ1��ʾ��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A��____K��B��������>������<������=������ͬ����
������ϵ��ѹǿ��P���Ĺ�ϵ��ͼ1��ʾ��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A��____K��B��������>������<������=������ͬ����
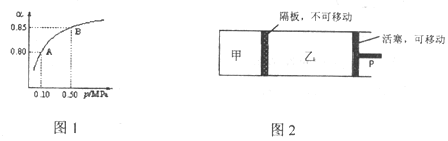
��3�������¶Ȳ��䣬�������ʵ�����SO2��O2�����ƽ�����ݣ��ֱ������ʼ�����ͬ�ļס����������У����ּ��������ݣ���������ѹ����ƽ�⣨��ͼ2������������SO2��ת���ʹ�ϵΪ![]() ��_____
��_____![]() ����
����
��4����ҵ�������β����������SO2���壬����NaClO2������Һ���գ��÷�Ӧ�����ӷ���ʽΪ��___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���±�Ϊ25��ʱijЩ����ĵ���ƽ�ⳣ����
CH3COOH | HClO | H2CO3 |
Ka=1.8��10��5 | Ka=3.0��10��8 | Ka1=4.4��10��7Ka2=4.7��10��11 |
��ͼ��ʾ�����£�ϡ��CH3COOH��HClO�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ���ǣ� ��
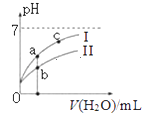
A.�����ߴ���HClO,�����ߴ���CH3COOH
B.��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��ClO��+CO2+H2O=HClO+CO32-
C.ͼ����a��c���㴦����Һ��![]() ��ȣ�HR����CH3COOH��HClO��
��ȣ�HR����CH3COOH��HClO��
D.ͼ����a�������Ũ�ȴ���b�������Ũ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com