

| 反应时间t/s | 1 | 4 | 9 | 16 |
| 镀层厚度y/nm | a | 2a | 3a | 4a |
分析 (1)化学镀不需通电;
(2)用热碱液清洗能除去镀件表面油污;表面粗化可增大接触面积;
(3)SnCl2与AgNO3反应生成银和四氯化锡和硝酸锡;
(4)Ni2+与H2PO2-反应生成镍、H3PO3及与金属镍物质的量相等的氢气;
(5)镀层厚度y与反应时间t的关系式为y=at1/2;将镀层厚度为6anm带入可得时间;
(6)由c(Ni2+)×c2(OH-)=2.0×10-15计算出c(Ni2+).
解答 解:(1)化学镀不需通电,电镀需要通电,故答案为:不需通电;
(2)用热碱液清洗能除去镀件表面油污,镀件表面粗化可增强亲水性及增大接触面积,故答案为:除去镀件表面油污;增大接触面积;
(3)SnCl2与AgNO3反应生成银和四氯化锡和硝酸锡,反应方程式为2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4,故答案为:2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4;
(4)Ni2+与H2PO2-反应生成镍、H3PO3及与金属镍物质的量相等的氢气,反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3,故答案为:2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3;
(5)根据表中数据可可知镀层厚度y与反应时间t的关系式为y=at1/2;将镀层厚度为6anm带入,可知t=36s,故答案为:y=at1/2;36s;
(6)由c(Ni2+)×c2(OH-)=2.0×10-15,c(Ni2+)=$\frac{2.0×10{\;}^{-15}}{(10{\;}^{-4}){\;}^{2}}$mol/L=2×10-7mol/L,即2×10-7mol•L-1×59g•mol-1=1.2×10-5g/L=1.2×10-2mg/L,
故答案为:1.2×10-2.
点评 本题电镀的制备流程,题目难度中等,本题易错点为(6),注意单位之间的换算.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:选择题
| A. | Z可以电离 | B. | Z可以表示为:XY2 | C. | X形成+2价阳离子 | D. | Z的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氢氧燃料电池的正极反应:H2-2e-+2OH-═2H2O | |
| B. | 用电子式表示NaCl的形成过程: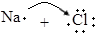 →Na+[ →Na+[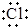 ]- ]- | |
| C. | 少量二氧化硫通入次氯酸钠碱性溶液中:SO2+C1O一+2OH-═SO42-+Cl-+H2O | |
| D. | 汽车尾气系统的催化转化器可降低NO等的排放:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸都可以与钠反应生成氢气 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 甲苯和乙烯都可与溴水发生化学反应造成溴水褪色 | |
| D. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由图中信息可知HA为强酸,N点表示酸碱恰好中和 | |
| B. | 常温下,一定浓度的MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13.c(HA)+c(A-)=0.25mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 是制作电木的原料.下列围绕此物质的讨论正确的是( )
是制作电木的原料.下列围绕此物质的讨论正确的是( )| A. | 该有机物没有确定的熔点 | B. | 该有机物通过加聚反应得到 | ||
| C. | 该有机物通过苯酚和甲醇反应得到 | D. | 该有机物的单体是-C6H3OHCH2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com