
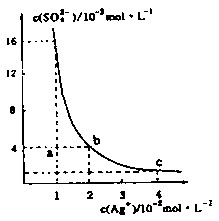
| A.b点对应的Ksp等于c点对应的Ksp |
| B.采取蒸发溶剂的方法可以使溶液从a点变到b点 |
| C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol·L-1)2 |
| D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
科目:高中化学 来源:不详 题型:单选题
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3 。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
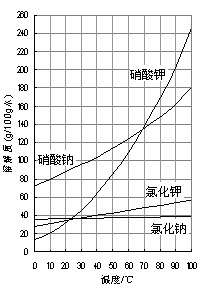
| A.氯化钠 |
| B.硝酸钠 |
| C.氯化钾 |
| D.硝酸钾 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaSO4溶解度增大,Ksp不变 |
| B.BaSO4溶解度、Ksp增大 |
| C.BaSO4溶解度不变,Ksp增大 |
| D.BaSO4溶解度、Ksp均不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
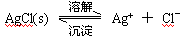
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 氧化钙的悬浊液中,存在如下溶解平衡关系:
氧化钙的悬浊液中,存在如下溶解平衡关系:| A.溶液中Ca2+数减小 |
| B.溶液中c(Ca2+)减小 |
| C.溶液中c(OH-)增大 |
| D.pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 入一滴AgNO3溶液,出现白色沉淀,继续加入一
入一滴AgNO3溶液,出现白色沉淀,继续加入一 滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为()
滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为()| A.KSP(AgCl)=KSP(AgI)=KSP(Ag2S) | B.KSP(AgCl)<KSP(AgI)<KSP(Ag2S) |
| C.KSP(AgCl)>KSP(AgI)>KSP(Ag2S) | D.因发生特殊反应,无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com