
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
①2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g)ΔH1=+3 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1=+3 359.26 kJ·mol-1
②CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3= kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
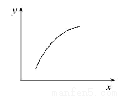
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
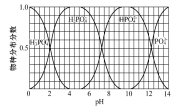
①为获得尽可能纯的NaH2PO4,pH应控制在 ; pH=8时,溶液中主要含磷物种浓度大小关系为 。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (写离子方程式)。
(4)磷的化合物三氯氧磷(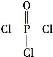 )与季戊四醇(
)与季戊四醇(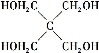 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。

①酸性气体是 (填化学式)
②X的结构简式为 。
(1)2821.6;
(2)0.3mol;
(3)①4~5.5 c(HPO42-)>c(H2PO4)②3Ca2++2H PO42-=Ca3(PO4)2+2H+
(4)①HCl ②
【解析】
试题分析:(1)①+②×6整理可得2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g)ΔH3=ΔH1+6×ΔH2=+3359.26+6×(-89.61)=2821.6kJ/mol. (2)由方程式11P4+60CuSO4 +96H2O
6CaSiO3(s)+P4(s)+10CO(g)ΔH3=ΔH1+6×ΔH2=+3359.26+6×(-89.61)=2821.6kJ/mol. (2)由方程式11P4+60CuSO4 +96H2O 20Cu3P +24H3PO4+60H2SO4 可知:P4在反应中既作氧化剂又作还原剂。CuSO4作氧化剂。每1mol的CuSO4得到电子1mol。而每1mol的P4在反应中作还原剂能失去电子20mol的电子。即1mol的P4在反应中作还原剂需要消耗20mol的CuSO4,则6 mol CuSO4能氧化白磷的物质的量是6÷20=0.3mol。(3)由含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系图可知:①为获得尽可能纯的NaH2PO4,pH应控制pH在4~5.5。在pH=8时溶液中主要含磷物种有Na2HPO4 和NaH2PO4二者浓度大小关系为c(HPO42-)>c(H2PO4--)。②Na2HPO4溶液显碱性,是因为在溶液在存在电离平衡:HPO42-
20Cu3P +24H3PO4+60H2SO4 可知:P4在反应中既作氧化剂又作还原剂。CuSO4作氧化剂。每1mol的CuSO4得到电子1mol。而每1mol的P4在反应中作还原剂能失去电子20mol的电子。即1mol的P4在反应中作还原剂需要消耗20mol的CuSO4,则6 mol CuSO4能氧化白磷的物质的量是6÷20=0.3mol。(3)由含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系图可知:①为获得尽可能纯的NaH2PO4,pH应控制pH在4~5.5。在pH=8时溶液中主要含磷物种有Na2HPO4 和NaH2PO4二者浓度大小关系为c(HPO42-)>c(H2PO4--)。②Na2HPO4溶液显碱性,是因为在溶液在存在电离平衡:HPO42- H++ PO43-和水解平衡:H2O+HPO42-
H++ PO43-和水解平衡:H2O+HPO42- H2PO4--+OH-。由于水解大于电离,所以溶液显碱性。若向溶液中加入足量的CaCl2溶液,则会发生反应:2PO43-+3Ca2+= Ca3(PO4)2↓。促使平衡向电离的方向移动,最终使溶液显酸性。总方程式为3Ca2++2H PO42-=Ca3(PO4)2+2H+。(4)由它们反应时的物质的量的关系、质量守恒定律及得到的物质的核磁共振氢谱图可以确定①酸性气体是HCl,②X的结构简式为
H2PO4--+OH-。由于水解大于电离,所以溶液显碱性。若向溶液中加入足量的CaCl2溶液,则会发生反应:2PO43-+3Ca2+= Ca3(PO4)2↓。促使平衡向电离的方向移动,最终使溶液显酸性。总方程式为3Ca2++2H PO42-=Ca3(PO4)2+2H+。(4)由它们反应时的物质的量的关系、质量守恒定律及得到的物质的核磁共振氢谱图可以确定①酸性气体是HCl,②X的结构简式为 。
。
考点:考查盖斯定律的应用、氧化还原反应中氧化剂与还原剂的电子转移关系、微粒的浓度与溶液的酸碱性的关系和核磁共振氢谱在确定物质结构中的应用的知识。


科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
某学生实验小组用50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定。

(1)图中装置缺少一种仪器,该仪器名称为______。
(2)下列说法正确的是______。
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
氯化钴溶液中存在下列平衡:CoCl42-(蓝色) Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
A.由蓝色变为粉红色 B.红色加深
C.由粉红色变为蓝色 D.蓝色加深
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
有A、B、C、D四种金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线连接后浸入稀H2SO4中,电流由D导线C;③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应,试判断四种金属的活动顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g) 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应: 3A(g) 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
A.若x=2,则p>0.5a B.若x=3,则p<0.7a
C.若x=4,则p= a D.若x= 5,则p≥a
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+ CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项 | X | Y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH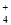 )> c(SO
)> c(SO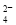 )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO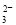 )+c(HCO
)+c(HCO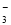 )+c(OH-)
)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO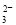 )
)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
利用实验器材(规格和数量不限),能完成相应实验的一项是
| 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com