
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加入NaHCO3使氯水的漂白能力增强 | |
| C. | 难溶电解质可以由溶解度小的转化为溶解度更小的,但不能从溶解度小的转化为溶解度大的 | |
| D. | Ksp只受温度的影响,不受浓度的影响 |
分析 A.△H-T△S<0的反应能够自发进行;
B.加入NaHCO3与盐酸反应,使Cl2+H2O?HClO+HCl平衡正向移动;
C.用适当试剂把沉淀能溶解;
D.Ksp只与温度有关.
解答 解:A.△H>0的反应能够自发进行时,△S必须大于0,故A正确;
B.加入NaHCO3与盐酸反应,使Cl2+H2O?HClO+HCl平衡正向移动,HClO浓度增大,使氯水的漂白能力增强,故B正确;
C.只要用适当试剂把沉淀溶解就是把溶解度小的物质转化为溶解度大的物质,故C错误;
D.Ksp只与温度有关,与浓度无关,故D正确.
故选C.
点评 本题考查自发反应、化学平衡、沉淀转化以及溶度积等,难度不大,注意只要用适当试剂把沉淀溶解就是把溶解度小的物质转化为溶解度大的物质.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
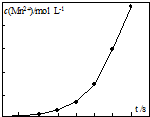 草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
草酸钠滴定法测定高锰酸钾的质量分数步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
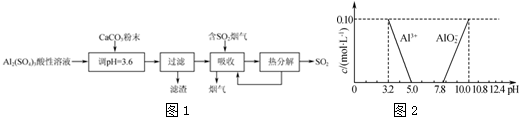
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
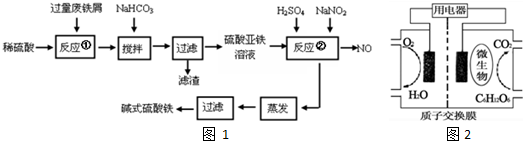
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
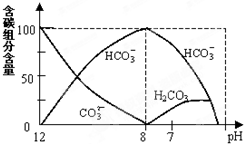 在含有弱电解质的溶液中,往往有多个化学平衡共存
在含有弱电解质的溶液中,往往有多个化学平衡共存查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 结论 |
| A | 乙烯分别通入酸性高锰酸钾和溴的四氯化碳溶 液,两溶液都褪色 | 这两个反应类型相同 |
| B | 油脂、多糖、蛋白质都能水解 | 三者都是天然高分子化合物 |
| C | 乙醇和乙酸都能和钠反应 | 两者的结构中都含有羟基 |
| D | 葡萄糖和乙醛都能和新制的氢氧化铜反应 | 两者的结构中都含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
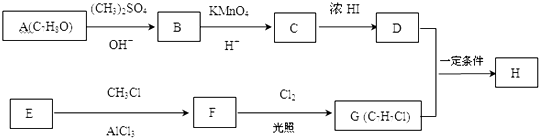
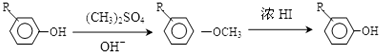
 ,由C生成D的化学方程式为
,由C生成D的化学方程式为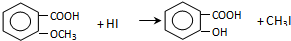 .
.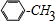 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$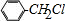 +HCl.反应类型为取代反应
+HCl.反应类型为取代反应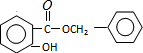 .
. (或
(或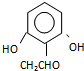 ).
).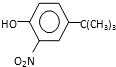 ,反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
,反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为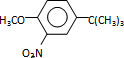 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.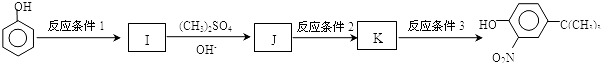
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
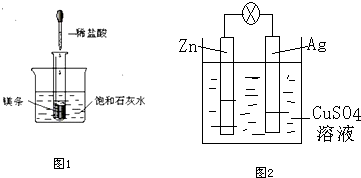
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com