
| A. | 明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化 | |
| B. | 镀锡的铁制品比镀锌的铁制品耐腐蚀 | |
| C. | pH=6的某溶液一定呈酸性 | |
| D. | 二次电池充电时,电池上标有“+”的电极应与外接电源的正极相连 |
分析 A.氢氧化铝胶体具有吸附性,能够净水;
B.依据锌活泼性强于铁强于锡,结合原电池工作原理解答;
C.据PH值与溶液酸碱性的关系判断;
D.充电时,为电解池,电池上标注“+”的电极应与外接电源的正极相连.
解答 解:A.明矾水解形成的Al(OH)3胶体具有吸附性,可用于水的净化,不具有杀菌消毒作用,故A错误;
B.镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀.所以,镀锌铁比镀锡铁耐用.发生原电池反应而可用电化学知识解释,故B错误;
C.溶液pH与温度、氢离子浓度都有关系,温度未知无法确定pH=6溶液酸碱性,故C错误;
D.充电时,电池上标注“+”的电极应与外接电源的正极相连,故D正确;
故选:D.
点评 本题为综合题,涉及盐类水解的应用、金属的腐蚀与防护、溶液酸碱性判断,明确盐类水解实质、熟悉原电池、电解质工作原理、溶液酸碱性判断及pH值概念是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
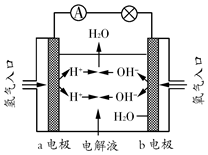 化学电池在通讯、交通及日常生活中有着广泛的应用.
化学电池在通讯、交通及日常生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
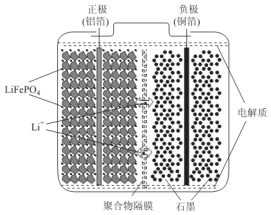
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
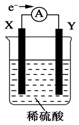 在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为X→外电路→Y | |
| B. | 若两电极分别为铁和碳棒,则铁棒进行的电极反应式为2H++e-═H2↑ | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序是X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6gCH2═CHCHO中含有双键的数目为0.1NA | |
| B. | 标准状况下,44.8 L丙三醇与足量金属钠反应,生成气体的分子数为3NA | |
| C. | 粗铜的电解精炼中,阳极质量减轻64g时,转移的电子数为2NA | |
| D. | 15g甲基正离子(+CH3)所含有的电子数是8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | 该反应属于离子反应 | |
| C. | 若有0.1mol氯气参与反应,则转移电子0.1mol | |
| D. | 该反应中Cl2既是氧化剂又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com