

分析 FeSO4(含有TiOSO4)中加水和过量铁粉,TiO2+水解生成H2TiO3沉淀,过滤得到的滤渣为H2TiO3,滤液为硫酸亚铁溶液,在滤液中加(NH4)2SO4,生成(NH4)2Fe(SO4)2,对溶液进行蒸发浓缩、冷却结晶、过滤即可得到(NH4)2Fe(SO4)2晶体;
(1)把已知的热化学方程式相加即得到水分解的热化学方程式;
(2)TiO2+水解生成H2TiO3沉淀;Fe粉能防止亚铁离子被氧化,Fe消耗氢离子能促进TiO2+水解;
(3)在FeSO4溶液中加(NH4)2SO4会生成(NH4)2Fe(SO4)2;(NH4)2Fe(SO4)2溶液中亚铁离子和铵根离子均能水解,溶液显酸性;
(4)由题中信息可知亚铁离子在碱性条件下易被氧化;
(5)根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)计算氢氧根离子的浓度,然后求出pH.
解答 解:FeSO4(含有TiOSO4)中加水和过量铁粉,TiO2+水解生成H2TiO3沉淀,过滤得到的滤渣为H2TiO3,滤液为硫酸亚铁溶液,在滤液中加(NH4)2SO4,生成(NH4)2Fe(SO4)2,对溶液进行蒸发浓缩、冷却结晶、过滤即可得到(NH4)2Fe(SO4)2晶体;
(1)①4H2 O(g)+3Fe(s)═Fe3O4(s)+4H2(g)△H=a kJ/mol
②Fe3O4(s)=3Fe(s)+2O2(g)△H=b kJ/mol
由盖斯定律:(①+②)×$\frac{1}{4}$得H2 O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=$\frac{1}{4}$×(a+b)=$\frac{1}{4}$(a+b)kJ/mol,
故答案为:H2 O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=$\frac{1}{4}$(a+b)kJ/mol;
(2)TiO2+水解生成H2TiO3沉淀,其水解的离子方程式为TiO2++2H2O═2H++H2TiO3↓;亚铁离子在溶液中易被氧化,加Fe粉能防止亚铁离子被氧化,Fe消耗溶液中的氢离子能促进TiO2+水解,
故答案为:TiO2+;防止Fe2+被氧化为Fe3+;消耗溶液中的H+促进TiO2+水解;
(3)在FeSO4溶液中加(NH4)2SO4会生成(NH4)2Fe(SO4)2,其反应方程式为:(NH4)2SO4+FeSO4=(NH4)2Fe(SO4)2;(NH4)2Fe(SO4)2溶液中亚铁离子和铵根离子均能水解,溶液显酸性,则离子溶度由大到小的顺序:C(SO42-)>C(NH4+)>C(Fe2+)>C(H+)>C(0H-);
故答案为:(NH4)2SO4+FeSO4=(NH4)2Fe(SO4)2; C(SO42-)>C(NH4+)>C(Fe2+)>C(H+)>C(0H-);
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化,说明二价铁离子在碱性条件下易被氧化,(NH4)2Fe(SO4)2在溶液中电离出来的铵根离子和二价铁离子均发生水解,水解后的溶液的酸性强于FeSO4,则(NH4)2Fe(SO4)2的还原性小于FeSO4,所以更稳定;
故答案为:由题意可知二价铁离子在碱性条件下更易被氧化,(NH4)2Fe(SO4)2水解后的酸性强于FeSO4,则(NH4)2Fe(SO4)2的还原性小于FeSO4,所以更稳定;
(5)室温时Fe(OH)3的悬浊液中存在Fe(OH)3(s)?Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3]=8ⅹ10-32若此悬浊液中 c(Fe3+)=0.08mol•L-1,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=0.08×c3(OH-)=8×10-32,则c(OH-)=10-10mol/L,所以c(H+)=10-4mol/L,则pH=4,
故答案为:4.
点评 本题考查了盖斯定律的应用、物质的制备、物质的分离、溶度积常数的有关计算等,侧重于学生的分析能力、实验能力的考查,分析流程掌握物质性质和实验基本操作是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏的方法来分离甲苯、溴苯和辛烷的混合物 | |
| B. | 催化裂化不仅可以提高汽油的产量而且可以提高汽油质量 | |
| C. | 裂化汽油可使溴水褪色 | |
| D. | 裂解的目的是获得乙烯、丙烯、丁二烯等短链不饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H278Se的稳定性比H2S稳定性强 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同素异形体 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se组成的气态物质属于化合物 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,分别含有44和46个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑧ | ⑩ | |||
| 3 | ① | ⑦ | ⑨ | |||||
| 4 | ② | ③ |
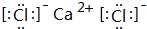 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 熔点:金刚石>NaCl>冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的邻二氯取代产物只有一种 | ||
| C. | 苯不使溴的四氯化碳溶液褪色 | D. | 苯的对二氯取代产物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com