
在容积为2 L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)?反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)?反应时间t的变化曲线如图所示,下列说法正确的是( )
A.该反应的ΔH>0
B.其他条件不变,升高温度反应的平衡常数增大
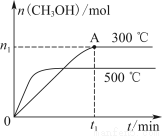
C.300 ℃时,0~t1 min内 CH3OH的平均生成速率为 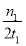 mol·L-1·min-1
mol·L-1·min-1
D.A点的反应体系从300 ℃升高到500 ℃,达到平衡时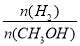 减小
减小
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
下表是五种银盐的溶度积常数(25 ℃):
化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法不正确的是( )
A.五种物质在常温下Ag2SO4饱和溶液中c(Ag+)最大
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A.由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、ClO-、I-
B.c(H+)= 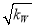 mol/L的溶液中:K+、Fe3+ 、Cl-、CO32—
mol/L的溶液中:K+、Fe3+ 、Cl-、CO32—
C.常温下,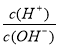 =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D.pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷B(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1

测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和3 mol H2
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”“等于”或“小于”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:

请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
氨的催化氧化过程主要有以下两个反应:
(ⅰ)4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
(ⅱ)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
测得温度对NO、N2产率的影响如图所示。下列说法错误的是( )
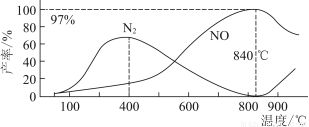
A.升高温度,反应(ⅰ)和(ⅱ)的平衡常数均减小
B.840 ℃后升高温度,反应(ⅰ)的正反应速率减小,反应(ⅱ)的正反应速率增大
C.900 ℃后,NO产率下降的主要原因是反应(ⅰ)平衡逆向移动
D.800 ℃左右时,氨的催化氧化主要按照(ⅰ)进行
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
元素性质元素编号
ABCDEFGH
原子半径(nm)0.1020.1100.1170.0740.0750.0710.0990.077
最高化合价+6+5+4+5+7+4
最低化合价-2-3-4-2-3-1-1-4
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2 是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是________________;
(2)C和H的气态氢化物的稳定性强弱关系为______________(用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_____________________________________。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3===2________+CO2
横线上某盐的化学式应为________。
(5)在一密闭容器中发生反应2AD2+D2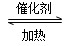 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。在下列方框内绘出该实验方案装置图。

查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是( )
A.Y、Z、R 3种元素组成的化合物水溶液一定显碱性
B.原子半径:Z>R>W
C.气态氢化物稳定性:HW>H2R
D.XW4分子中各原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:选择题
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-a kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-b kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-c kJ·mol-1(a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是( )
A.a>b>c B.a>c>b C.c>b>a D.b>a>c
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:选择题
下列化学工业有关设备、原料、反应条件配套的是 ( )
A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30 ℃~35 ℃的氨化饱和食盐水吸收CO2
B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000~5000 ℃
C.合成氨:沸腾炉、焦炭、铁触媒、500 ℃
D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com