
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z+n) |
| C、所含电子数为(Z-n) |
| D、中子数-电子数=A-2Z-n |


科目:高中化学 来源: 题型:
| A、因为红磷燃烧能产生大量白烟,所以可用于制作烟幕弹 |
| B、因为铜的化学性质不活泼,所以可镀在某些铁制品表面防止铁生锈 |
| C、因为氮气的化学性质不活泼,所以常用于食品包装袋内防变质 |
| D、因为CO有可燃性,所以常用于冶炼金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 |
| B、0.15mol?L-1 |
| C、0.2mol?L-1 |
| D、0.3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、沸水中滴入FeCl3饱和溶液:Fe3++3H2O
| ||||
| B、一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ | ||||
| C、用氢氧化钠溶液吸收过量二氧化碳 OH-+CO2=HCO3- | ||||
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑ |
| B、用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| C、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2-+5 H+═Al(OH)3↓+Al3++H2O |
| D、碳酸氢钠溶液与少量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属铁和稀盐酸反应的化学方程式:2Fe+6HCl=2FeCl3+3 H2↑ | ||
| B、碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- | ||
C、氯原子的结构示意图: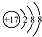 | ||
D、中子数为146、质子数为92的铀(U)原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性氧化物都是非金属氧化物 |
| B、一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C、丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应 |
| D、熔融状态能导电的物质一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向未知溶液中加入硝酸银溶液,有白色沉淀产生 |
| B、向未知溶液中加入硝酸银溶液,有白色沉淀产生,加入盐酸后.沉淀不消失 |
| C、向未知溶液中加入稀硝酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
| D、向未知溶液中加入稀盐酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
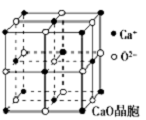 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
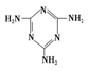 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (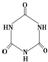 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com