
【题目】小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是:_____________________________________。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①探究Fe2+的还原性,若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,你认为可能观察到的现象是:溶液由浅绿色变为_________色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选________滴入小明所得的混合液中,并通过溶液出现_____________色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果发现铜片没变化,锌粒逐渐溶解变小。由此说明三种金属的还原性由强至弱的顺序为:____________________________。
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成__________(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成__________。
②实际上Fe2+的还原性较强,Fe2+被H2O2氧化成Fe3+,反应的离子方程式为:2Fe2++ H2O2+ 2H+=2Fe3++ 2H2O,请用双线桥标出电子转移情况:__________________。
【答案】因为Fe2+中铁元素化合价处于中间价态,可升也可降 黄色或棕黄色 硫氰酸钾溶液或KSCN溶液 血红色 Zn Fe Cu Fe Fe3+ 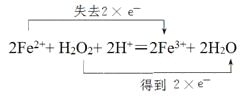
【解析】
(1)元素化合价处于最高价只具有氧化性,处于最低价只具有还原性,处于中间价态既可以升高也可以降低,既具有氧化性又具有还原性;故答案为:因为Fe2+中铁元素化合价处于中间价态,可以升高也可以降低;
(2)①在0.1molL-1FeCl2溶液滴入新制氯水,氯气具有强氧化性能源和亚铁离子为铁离子,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;溶液颜色从浅绿色变为黄色;故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;黄;②通过检验Fe2+被氧化的产物Fe3+的存在以获取证据.需要的试剂为硫氰酸钾溶液,发生反应,Fe3++3SCN-=Fe(SCN)3,溶液变血红色,故答案为:硫氰酸钾溶液;血红;③金属单质都具有还原性,分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小,发生反应Zn+Fe2+=Fe+Zn2+;氧化还原反应中还原剂的还原性大于还原产物,锌的还原性大于铁,铁大于铜,故答案为:Zn Fe Cu
(3)①若Fe2+在反应中表现出氧化性,化合价降低做氧化剂,只能降到0价为金属铁,若Fe2+在反应中表现出还原性,铁元素化合价升高为三价,应转化成三价铁离子;故答案为:Fe,Fe3+;②用双线桥标出电子转移情况为:



科目:高中化学 来源: 题型:
【题目】对于反应mA(s)+nB(g)![]() eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
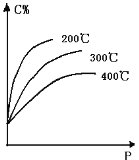
A. 化学方程式中n<e+f
B. 达到平衡后,加入催化剂,则C%增大
C. 达到平衡后,若升温,平衡逆向移动
D. 达到平衡后,增加A的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18gmL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_________ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)=_____mol·L-1。
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,以下说法正确的是
A. 标准状况下,11.2LH2O含H2O分子0.5NA
B. 1molFe与1molCl2充分反应转移电子3NA
C. 常温常压下,32g O2与O3的混合气中含氧原子2NA
D. 将0.1molFeCl3滴入沸水所形成胶体中含有氢氧化铁胶体粒子数目为 0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1)![]() 键和
键和![]() 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:
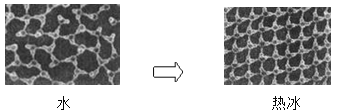
使水结成“热冰”采用“弱电场”的条件,说明水分子是______分子。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用力类型完全相同的是______。
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式__________;该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式____________________。
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因______________________;试从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是___________________________。
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为________g/cm3(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知19.2gCu与过量的200mL5mol/L 稀硝酸充分反应,反应方程式如下:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)写出该反应的离子方程式:________;
(2)标准状况下,产生NO气体的体积为:________;转移电子的物质的量为______;反应后NO3-的物质的量浓度为:______。(忽略反应前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
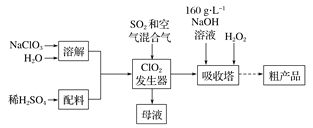
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:
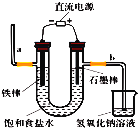
①请写出该反应的化学方程式____。
②通电后,b侧产生的气体是____![]() 填化学式
填化学式![]() 。
。
(2)某学生设计如图所示的实验装置,利用浓盐酸和二氧化锰固体制取氯气,并与潮湿的消石灰反应制取少量漂白粉![]() 这是一个放热反应
这是一个放热反应![]() ,回答下列问题:
,回答下列问题:
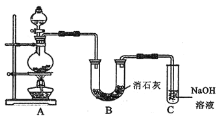
①漂白粉将在B装置的U形管中产生,其化学方程式是_____。
②装置C的作用是___。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3) 2,为避免此副反应的发生,可采取的措施是___。
②为避免另一个副反应的发生,可将装置作何改进___ 。
③家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是____。
A.食盐 B.食醋 C.烧碱 D.纯碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com